G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,727
- Solutions
- 3
- Reaction score
- 2,888
- Points
- 113
- Deals
- 1
Introduzione
Come trasformare i grammi in millilitri e viceversa?
Che cosa sono le moli?
Che cos'è la massa molare?
Come trasformare le moli in grammi e viceversa?
Un altro esempio: si devono aggiungere alla reazione 10 moli di boroidruro di sodio (NaBH4) con una massa molecolare di 37,83 g/mole e si deve contare in grammi:
Come si contano i reagenti?
Come contare la resa di una reazione?
Poi, bisogna contare quante moli di un reagente mancante (P2P in questo esempio) partecipano alla reazione.
Ricevo molte domande sulla resa delle reazioni, sulla quantità di reagenti, su come trasformare una dimensione in un'altra e noto che le persone non sanno come contare correttamente questi numeri semplici ma molto importanti. Ho deciso di descrivere i metodi corretti in questo topic. Se non capite qualcosa, non esitate a chiedere e a discutere le vostre domande nella sezione dei commenti.
Come trasformare i grammi in millilitri e viceversa?
Il grammo (simbolo SI g) è un'unità di massa del SistemaInternazionale di Unità di Misura(SI) pari a un millesimo di chilogrammo (1/1000). Ilgrammo è il peso assoluto di un volume di acqua pura pari al cubo della centesima parte di un metro [1 cm3], e alla temperatura di fusione del ghiaccio; la temperatura di definizione (~0 °C) è stata successivamente modificata in 4 °C, la temperatura di massima densità dell'acqua.
Fattori di conversione
Fattori di conversione
- 1 grammo (g) = 15,4323583529 grani (gr).
- 1 grano (gr) = 0,06479891 grammi.
- 1 oncia avoirdupois (oz) = 28,349523125 grammi.
- 1 oncia troy (ozt) = 31,1034768 grammi.
- 100 grammi (g) = 3,527396195 once (oz).
- 1 carato (ct) = 0,2 grammi.
- 1 gamma (γ) = 10-6 grammi.
- 1 undecimogrammo = 1 "undicesimo grammo" = 10-11 grammi nel sistema storico quadrante-elevato-grammo-secondo (sistema QES), noto anche come sistema ebdometrico-undecimogrammo-secondo (sistema HUS).
- 500 grammi (g) = 1 jin nelle unità di misura cinesi.
Il litro (grafia internazionale) o il litro (grafia inglese americana), simboli SI L e l. Il litro è un'unità metrica di volume. È pari a 1 decimetro cubo (dm3), 1000 centimetri cubi (cm3) o 0,001 metri cubi (m3). Un decimetro cubo (o litro) occupa un volume di 10 cm × 10 cm × 10 cm (vedi figura) ed è quindi pari a un millesimo di metro cubo. Millilitro, simbolo SI ml o mL è il centimetro cubo. Un centimetro cubo (o ml) occupa un volume di 1 cm × 1 cm × 1 cm ed è quindi pari a un millesimo di litro (1/1000).
Fattori di conversione

Fattori di conversione
- 1 quarto imperiale = 1,1365225 L.
- 1 quarto americano = 0,946352946 L.
- 1 pinta imperiale = 0,56826125 L.
- 1 pinta statunitense = 0,473176473 L.
- 1 gallone imperiale = 4,54609 L.
- 1 gallone americano = 3,785411784 L.
- 1 piede cubo = 28,316846592 L.
- 1 pollice cubo = 0,016387064 L.
- 1 oncia fluida imperiale = 28,4130625 mL.
- 1 oncia fluida statunitense = 29,5735295625 mL.
Igrammi possono essere facilmente trasformati in millilitri secondo questa formula.
V = m / ρ.
dove m - massa della sostanza, g; ρ - densità della sostanza, g/ml; V - volume della sostanza.
Secondo questa formula, è possibile trasformare ogni sostanza in volume e viceversa. Per esempio, abbiamo20 g di mercurio (Hg) e vogliamo calcolarne la massa. ρ (densità) del mercurio è 13,5 g/ml, quindi
Secondo questa formula, è possibile trasformare ogni sostanza in volume e viceversa. Per esempio, abbiamo20 g di mercurio (Hg) e vogliamo calcolarne la massa. ρ (densità) del mercurio è 13,5 g/ml, quindi
V(Hg) = 20 g / 13,5 g/ml = 1,48 ml
1,48 ml è il volume di 20 g di mercurio.
Che cosa sono le moli?
La mole, simbolo mol, n, è l'unità di misura della quantità di sostanza nel Sistema Internazionale di Unità di Misura (SI). La quantità di sostanza è una misura di quante entità elementari di una data sostanza sono presenti in un oggetto o in un campione (in qualsiasi sostanza). La mole è definita come contenente esattamente 6,02214085774 × 10²³ particelle (atomi, molecole, ioni, elettroni o qualsiasi altro oggetto). Ad esempio, 10 moli di acqua (un composto chimico H2O) e 10 moli di mercurio (un elemento chimico Hg), contengono quantità uguali di sostanza e il mercurio contiene esattamente un atomo per ogni molecola dell'acqua, nonostante i due abbiano volumi e masse diverse. In ogni caso, si tratta di una quantità notevole, non è vero? Questo è il motivo per cui è più conveniente sapere come convertire i grammi in moli anziché i grammi in numero di atomi.
Che cos'è la massa molare?
La massa molare è una caratteristica di una sostanza, il rapporto tra la massa di una sostanza e la sua quantità. Numericamente è uguale alla massa di 1 mole di una sostanza, cioè la massa di una sostanza contiene un numero di particelle pari al numero di Avogadro. La massa molare, espressa in g/mol, coincide numericamente con la massa molecolare, espressa in r.a.m., e la massa atomica relativa. Tuttavia, c'è una differenza tra la massa molare e la massa molecolare, che sono uguali solo numericamente e differiscono nella dimensione.
Per esempio, la massa molare dell'ossigeno come elemento M(O) = 16 g/mol, ma come sostanza semplice costituita da molecole O2 = 32 g/mol.
Le masse molari delle molecole complesse possono essere determinate sommando le masse molari dei loro elementi costitutivi. Ad esempio,la massa molecolare dell'acqua H2O è.
Per esempio, la massa molare dell'ossigeno come elemento M(O) = 16 g/mol, ma come sostanza semplice costituita da molecole O2 = 32 g/mol.
Le masse molari delle molecole complesse possono essere determinate sommando le masse molari dei loro elementi costitutivi. Ad esempio,la massa molecolare dell'acqua H2O è.
M(H2O) = 2 x M(H) + M(O) = 2 x 1 g/mol + 16 g/mol = 18 g/mol.
Come trasformare le moli in grammi e viceversa?
Per valutare correttamente il numero di moli, n, di una sostanza di una massa specifica, m, (in grammi), è necessario seguire la formula grammi-moli.
n = m / M.
dove: M - la massa molare di questo materiale. L'unità di misura è tipicamente g/mol; m - massa della sostanza, g; n - moli della sostanza, mol.
Per esempio, si hanno 100 g di P2NP, che ha una massa molecolare di 163,17 g/mol. È necessario calcolare il numero di moli. In base alla formula precedente.
Per esempio, si hanno 100 g di P2NP, che ha una massa molecolare di 163,17 g/mol. È necessario calcolare il numero di moli. In base alla formula precedente.
n(P2NP) = 100 g / 163,17 g/mol = 0,6129 moli.
Un altro esempio: si devono aggiungere alla reazione 10 moli di boroidruro di sodio (NaBH4) con una massa molecolare di 37,83 g/mole e si deve contare in grammi:
m(NaBH4) = 10 moli x 37,83 g/mol = 378,3 g.
Come si contano i reagenti?
Avete aperto il manuale di sintesi e vi siete resi conto che avete bisogno di una sintesi su scala minore o maggiore. Siete confusi dai numeri e non sapete come contarli in base alla vostra scala? C'è una spiegazione.
Nel caso in cui vogliate aumentare la scala di una sintesi e siate sicuri che sia possibile farlo secondo la dipendenza lineare, basta moltiplicare tutte le quantità di reagenti per lo stesso indice. Otterrete le quantità di reagenti per la vostra scala di sintesi e non dovrete chiedere a nessun esperto!
Esempio: volete effettuare la sintesi di anfetamina via NaBH4/CuCl2 e dovete prendere 1000 g di P2NP per questa sintesi secondo il manuale del forum BB. Volete effettuare un carico di sintesi di 150 g di P2NP. Il vostro algoritmo è.
Nel caso in cui vogliate aumentare la scala di una sintesi e siate sicuri che sia possibile farlo secondo la dipendenza lineare, basta moltiplicare tutte le quantità di reagenti per lo stesso indice. Otterrete le quantità di reagenti per la vostra scala di sintesi e non dovrete chiedere a nessun esperto!
Esempio: volete effettuare la sintesi di anfetamina via NaBH4/CuCl2 e dovete prendere 1000 g di P2NP per questa sintesi secondo il manuale del forum BB. Volete effettuare un carico di sintesi di 150 g di P2NP. Il vostro algoritmo è.
1. Dividere 1000 g della quantità di precursore principale P2NP descritta nel manuale per 150 g e si otterrà l'indice necessario 6,67.
2. Dividere tutte le quantità di reagenti per 6,67 e si raggiungerà l'obiettivo.
Nel caso in cui sianecessario scalare questo carico di sintesi da 1000 g di P2NP a 2500 g, seguire le seguenti istruzioni.
1. Dividere 2500 g di P2NP per 1000 g e si otterrà l'indice 2,5.
2. Moltiplicate tutti i reagenti per 2,5 e raggiungerete il vostro obiettivo.
Come contare la resa di una reazione?
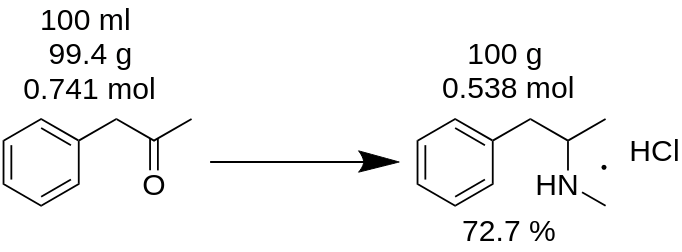
Avete effettuato la sintesi del cloridrato di metanfetamina da 100 ml di P2P e avete ottenuto 100 g di prodotto. Pensate di aver ottenuto una resa del 100%? È sbagliato!
Esempio.
Esempio.
Prima di tutto, bisogna contare la massa di P2P, che è stata utilizzata per questa sintesi.
m(P2P) = 100 ml / 1,006 = 99,4g
Poi, bisogna contare quante moli di un reagente mancante (P2P in questo esempio) partecipano alla reazione.
n(P2P) = 99,4 g / 134,178 g/mole = 0,741 moli.
Un reagente mancante è un reagente che prende parte alla reazione e che ha una quantità di moli minore. Ad esempio, nella reazione di amminazione riduttiva del P2P a metanfetamina, occorre prendere 1 mole di P2P e ~3,5 moli di metilammina. Il P2P è il reagente mancante in questa reazione.
Secondo il bilancio di reazione, 1 mole di P2P dà 1 mole di cloridrato di metanfetamina. Quindi, 0,741 moli di P2P danno 0,741 moli di cloridrato di metamfetamina (MH), che è
Secondo il bilancio di reazione, 1 mole di P2P dà 1 mole di cloridrato di metanfetamina. Quindi, 0,741 moli di P2P danno 0,741 moli di cloridrato di metamfetamina (MH), che è
m(MH) = 0,741 moli x 185,69 g/mole = 137,56 g.
dove 185,69 g/mole è la massa molecolare della metamfetamina cloridrato.
È nota come resa teorica. La resa teorica è la quantità di sostanza che deve essere ottenuta come risultato della reazione. Pertanto, è possibile calcolare la resa di reazione da questo risultato teorico.
È nota come resa teorica. La resa teorica è la quantità di sostanza che deve essere ottenuta come risultato della reazione. Pertanto, è possibile calcolare la resa di reazione da questo risultato teorico.
Resa, % = (m(teoria)*100)/m(pratica),
Resa (MH) = (100 g * 100) / 137,56 = 72,7 %.
Resa (MH) = (100 g * 100) / 137,56 = 72,7 %.
Come si può vedere, la resa reale del 72,7% è davvero diversa dalla resa del 100%, che è stata erroneamente calcolata dalla massa di reazione. Il suoruolo è significativo nella produzione di qualsiasi sostanza.
Last edited:
