G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,727
- Solutions
- 3
- Reaction score
- 2,888
- Points
- 113
- Deals
- 1
Inleiding
Hoe zet je grammen om in milliliters en vice versa?
Wat is mol?
Wat is molaire massa?
Hoe zet je mollen om in grammen en omgekeerd?
Een ander voorbeeld: je moet 10 mol natriumboorhydride (NaBH4) met 37,83 g/mol moleculaire massa toevoegen aan de reactie en je moet het in grammen uitrekenen:
Hoe tel je reagentia?
Hoe tel je een reactieopbrengst?
Tel vervolgens hoeveel mol van een gebrekkig reagens (P2P in dit voorbeeld) aan de reactie deelneemt.
Ik krijg veel dezelfde vragen over de opbrengst van reacties, de hoeveelheid reagentia, hoe je een dimensie in een andere omzet en merk dat mensen niet weten hoe ze deze eenvoudige maar zeer belangrijke getallen correct moeten tellen. Ik heb besloten om in dit onderwerp de juiste methoden te beschrijven. Als je iets niet begrijpt, aarzel dan niet om vragen te stellen en je vragen te bespreken in het commentaargedeelte.
Hoe zet je grammen om in milliliters en vice versa?
De gram (SI-eenheidssymbool g) is een massa-eenheid in het Internationaal Stelselvan Eenheden(SI) die gelijk is aan één duizendste van een kilogram (1/1000). Gram is het absolute gewicht van een volume zuiver water dat gelijk is aan de kubus van het honderdste deel van een meter [1 cm3], en bij de temperatuur van smeltend ijs, de definiërende temperatuur (~0 °C) werd later veranderd in 4 °C, de temperatuur van de maximale dichtheid van water.
Conversiefactoren
Conversiefactoren
- 1 gram (g) = 15,4323583529 korrels (gr).
- 1 graan (gr) = 0,06479891 gram.
- 1 avoirdupois ounce (oz) = 28,349523125 gram.
- 1 troy ounce (ozt) = 31,1034768 gram.
- 100 gram (g) = 3,527396195 ounces (oz).
- 1 karaat (ct) = 0,2 gram.
- 1 gamma (γ) = 10-6 gram.
- 1 undecimogramme = 1 "eleventh-gram" = 10-11 gram in het historische kwadrant-eleventh-gram-second stelsel (QES-stelsel) alias hebdometre-undecimogram-second stelsel (HUS-stelsel).
- 500 gram (g) = 1 jin in de Chinese meeteenheden.
De liter (internationale spelling) of liter (Amerikaanse Engelse spelling), SI-symbolen L en l. Liter is een metrische eenheid van volume. Hij is gelijk aan 1 kubieke decimeter (dm3), 1000 kubieke centimeter (cm3) of 0,001 kubieke meter (m3). Een kubieke decimeter (of liter) heeft een volume van 10 cm × 10 cm × 10 cm (zie figuur) en is dus gelijk aan een duizendste van een kubieke meter. Milliliter, SI-symbool ml of ml is kubieke centimeter. Een kubieke centimeter (of ml) heeft een volume van 1 cm × 1 cm × 1 cm en is dus gelijk aan een duizendste van een liter (1/1000).
Conversiefactoren

Conversiefactoren
- 1 Keizerkwartier = 1,1365225 L.
- 1 Amerikaans kwart = 0,946352946 L.
- 1 Imperiale pint = 0,56826125 L.
- 1 Amerikaanse pint = 0,473176473 L.
- 1 Imperiale gallon = 4,54609 L.
- 1 Amerikaanse gallon = 3,785411784 L.
- 1 kubieke voet = 28,316846592 L.
- 1 kubieke inch = 0,016387064 L.
- 1 Imperial fluid ounce = 28,4130625 ml.
- 1 U.S. fluid ounce = 29,5735295625 mL.
Grammen kunnen eenvoudig worden omgezet in milliliters volgens deze formule.
V = m / ρ.
waarin m - massa van de stof, g; ρ - dichtheid van de stof, g/ml; V - volume van de stof.
Volgens deze formule kun je elke stof omzetten in volume en omgekeerd. Bijvoorbeeld, je hebt 20 g kwik (Hg) en je wilt de massa berekenen. ρ (dichtheid) van kwik is 13,5 g/ml, dus
Volgens deze formule kun je elke stof omzetten in volume en omgekeerd. Bijvoorbeeld, je hebt 20 g kwik (Hg) en je wilt de massa berekenen. ρ (dichtheid) van kwik is 13,5 g/ml, dus
V(Hg) = 20 g / 13,5 g/ml = 1,48 ml
1,48 ml Is het volume van 20 g kwik.
Wat is mol?
De mol, symbool mol, n, is de eenheid van hoeveelheid stof in het Internationaal Stelsel van Eenheden (SI). De hoeveelheid stof is een maat voor het aantal elementaire entiteiten van een bepaalde stof in een voorwerp of monster (in welke stof dan ook). De mol wordt gedefinieerd als een stof die precies 6,02214085774 × 10²³ deeltjes (atomen, moleculen, ionen, elektronen of andere objecten) bevat. Bijvoorbeeld, 10 mol water (een chemische verbinding H2O) en 10 mol kwik (een chemisch element Hg) bevatten gelijke hoeveelheden van de stof en het kwik bevat precies één atoom voor elke molecuul van het water, ondanks dat de twee verschillende volumes en verschillende massa's hebben. Hoe dan ook, dat is best veel, nietwaar? Daarom ishet handiger om te weten hoe je gram omrekent naar mol in plaats van gram naar het aantal atomen.
Wat is molaire massa?
Molaire massa is een eigenschap van een stof, de verhouding tussen de massa van een stof en de hoeveelheid ervan. Numeriek gelijk aan de massa van 1 mol van een stof, dat wil zeggen dat de massa van een stof een aantal deeltjes bevat dat gelijk is aan het getal van Avogadro. De molaire massa, uitgedrukt in g/mol, valt numeriek samen met de moleculaire massa, uitgedrukt in r.a.m., en de relatieve atoommassa. Er is echter een verschil tussen de molaire massa en de moleculaire massa, ze zijn alleen numeriek gelijk en verschillen in dimensie.
Bijvoorbeeld, de molaire massa van zuurstof als element M(O) = 16 g/mol, maar als eenvoudige stof bestaande uit moleculen O2 = 32 g/mol.
De molaire massa van complexe moleculen kan worden bepaald door de molaire massa van de samenstellende elementen op te tellen. Bijvoorbeeld, de moleculaire massa van water H2O is.
Bijvoorbeeld, de molaire massa van zuurstof als element M(O) = 16 g/mol, maar als eenvoudige stof bestaande uit moleculen O2 = 32 g/mol.
De molaire massa van complexe moleculen kan worden bepaald door de molaire massa van de samenstellende elementen op te tellen. Bijvoorbeeld, de moleculaire massa van water H2O is.
M(H2O) = 2 x M(H) + M(O) = 2 x 1 g/mol + 16 g/mol = 18 g/mol.
Hoe zet je mollen om in grammen en omgekeerd?
Om het aantal mol, n, van een stof met een bepaalde massa, m, (in grammen) correct te berekenen, moet je de formule van gram naar mol volgen.
n = m / M.
waarin: M - de molaire massa van dit materiaal. De eenheid is meestal g/mol; m - massa van de stof, g; n - mol van de stof, mol.
Je hebtbijvoorbeeld 100 g P2NP, dat 163,17 g/mol moleculaire massa heeft. Je moet berekenen hoeveel mol het is. Volgens bovenstaande formule.
Je hebtbijvoorbeeld 100 g P2NP, dat 163,17 g/mol moleculaire massa heeft. Je moet berekenen hoeveel mol het is. Volgens bovenstaande formule.
n(P2NP) = 100 g / 163,17 g/mol = 0,6129 mol.
Een ander voorbeeld: je moet 10 mol natriumboorhydride (NaBH4) met 37,83 g/mol moleculaire massa toevoegen aan de reactie en je moet het in grammen uitrekenen:
m(NaBH4) = 10 mol x 37,83 g/mol = 378,3 g.
Hoe tel je reagentia?
Je hebt de synthesehandleiding geopend en je realiseert je dat je veel minder of grootschaligere synthese nodig hebt. Je bent in de war door de getallen en weet niet hoe je ze op jouw schaal moet tellen? Er is een verklaring voor.
Als je de schaal van een synthese wilt vergroten en je weet zeker dat dit mogelijk is volgens een lineaire afhankelijkheid, hoef je alleen maar alle hoeveelheden reagentia met dezelfde index te vermenigvuldigen. Je krijgt dan hoeveelheden reagentia voor je syntheseschaal en je hoeft hier geen expert naar te vragen!
Voorbeeld: je wilt Amfetaminesynthese uitvoeren via NaBH4/CuCl2 en je moet 1000 g P2NP nemen voor deze synthese volgens de handleiding van BB forum. Je wilt 150 g P2NP syntheselading uitvoeren. Je algoritme is
Als je de schaal van een synthese wilt vergroten en je weet zeker dat dit mogelijk is volgens een lineaire afhankelijkheid, hoef je alleen maar alle hoeveelheden reagentia met dezelfde index te vermenigvuldigen. Je krijgt dan hoeveelheden reagentia voor je syntheseschaal en je hoeft hier geen expert naar te vragen!
Voorbeeld: je wilt Amfetaminesynthese uitvoeren via NaBH4/CuCl2 en je moet 1000 g P2NP nemen voor deze synthese volgens de handleiding van BB forum. Je wilt 150 g P2NP syntheselading uitvoeren. Je algoritme is
1. Deel 1000 g van de in de handleiding beschreven hoeveelheid hoofdprecursor P2NP door 150 g en je krijgt noodzakelijke index 6,67.
2. Deel alle reagenshoeveelheden door 6,67 en je bereikt je doel.
Als je deze syntheselading moet opschalen van 1000 g P2NP naar 2500 g, volg dan deze instructies.
1. Deel 2500 g P2NP door 1000 g en je krijgt index 2,5.
2. Vermenigvuldig alle reagentia met 2,5 en je bereikt je doel.
Hoe tel je een reactieopbrengst?
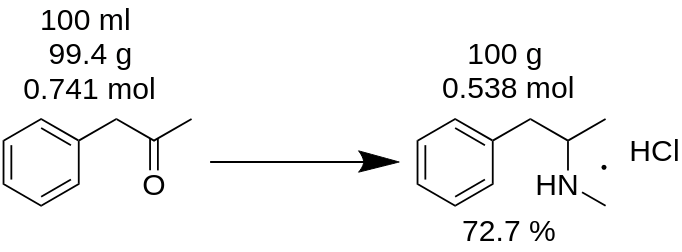
Je hebt methamfetaminehydrochloridesynthese uitgevoerd uit 100 ml P2P en 100 g van het product gekregen. Je denkt dat je 100% opbrengst hebt? Dat is fout!
Voorbeeld.
Voorbeeld.
Allereerstmoet je de massa van P2P tellen, die voor deze synthese is gebruikt.
m(P2P) = 100 ml / 1,006 = 99,4g
Tel vervolgens hoeveel mol van een gebrekkig reagens (P2P in dit voorbeeld) aan de reactie deelneemt.
n(P2P) = 99,4 g / 134,178 g/mol = 0,741 mol.
Een reagens dat ontbreekt is een reagens dat deelneemt aan een reactie en waarvan de hoeveelheid mol het kleinst is. Bijvoorbeeld, in de reactie van P2P reductieve aminering tot methamfetamine, moet je 1 mol P2P en ~3,5 mol methylamine nemen. P2P ontbreekt in deze reactie.
Volgens de reactiebalans geeft 1 mol P2P 1 mol methamfetaminehydrochloride. Dus 0,741 mol P2P geeft 0,741 mol methamfetaminehydrochloride (MH), dat is
Volgens de reactiebalans geeft 1 mol P2P 1 mol methamfetaminehydrochloride. Dus 0,741 mol P2P geeft 0,741 mol methamfetaminehydrochloride (MH), dat is
m(MH) = 0,741 mol x 185,69 g/mol = 137,56 g.
waarbij 185,69 g/mole de moleculaire massa van methamfetaminehydrochloride is.
In bekend als theoretische opbrengst. Theoretische opbrengst is de hoeveelheid stof die moet worden verkregen als het reactieresultaat. Daarom kun je de reactieopbrengst uit dit theoretische resultaat berekenen.
In bekend als theoretische opbrengst. Theoretische opbrengst is de hoeveelheid stof die moet worden verkregen als het reactieresultaat. Daarom kun je de reactieopbrengst uit dit theoretische resultaat berekenen.
Opbrengst, % = (m(theorie)*100)/m(praktijk),
Opbrengst (MH) = (100 g * 100) / 137,56 = 72,7%.
Opbrengst (MH) = (100 g * 100) / 137,56 = 72,7%.
Zoals je kunt zien, is de werkelijke opbrengst 72,7% echt anders dan de 100% opbrengst, die per ongeluk werd berekend op basis van de reactiemassa. Dit speelt een belangrijke rol bij de productie van stoffen.
Last edited:
