G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,727
- Solutions
- 3
- Reaction score
- 2,888
- Points
- 113
- Deals
- 1
Wprowadzenie
Jak zamienić gramy na mililitry i odwrotnie?
Co to są mole?
Czym jest masa molowa?
Jak zamienić mole na gramy i odwrotnie?
Inny przykład: do reakcji należy dodać 10 moli borohydratu sodu (NaBH4) o masie cząsteczkowej 37,83 g/mol i przeliczyć ją na gramy:
Jak liczyć odczynniki?
Jak policzyć wydajność reakcji?
Następnie należy policzyć, ile moli brakującego odczynnika (P2P w tym przykładzie) bierze udział w reakcji.
Otrzymuję wiele podobnych pytań dotyczących wydajności reakcji, ilości odczynników, sposobu zamiany jednego wymiaru na inny i zauważam, że ludzie nie wiedzą, jak poprawnie policzyć te proste, ale bardzo ważne liczby. Postanowiłem opisać poprawne metody w tym temacie. Jeśli czegoś nie rozumiesz, nie wahaj się zapytać i przedyskutować swoich pytań w sekcji komentarzy.
Jak zamienić gramy na mililitry i odwrotnie?
Gram (symbol jednostki SI g) to jednostka masy w Międzynarodowym Układzie JednostekMiar (SI) równa jednej tysięcznej kilograma (1/1000). Gram jest bezwzględną masą objętości czystej wody równej sześcianowi setnej części metra [1 cm3], a w temperaturze topnienia lodu, temperatura definiująca (~0 °C) została później zmieniona na 4 °C, temperaturę maksymalnej gęstości wody.
Współczynniki konwersji
Współczynniki konwersji
- 1 gram (g) = 15,4323583529 ziaren (gr).
- 1 ziarno (gr) = 0,06479891 grama.
- 1 uncjaavoirdupois (oz) = 28,349523125 gramów.
- 1 uncja trojańska (ozt) = 31,1034768 gramów.
- 100 gramów (g) = 3,527396195 uncji (oz).
- 1 karat (ct) = 0,2 grama.
- 1 gamma (γ) = 10-6 gramów.
- 1 undecymogram = 1 "jedenasty gram" = 10-11 gramów w historycznym systemie kwadrant-jedenasty gram-sekunda (system QES) vel system hebdometr-undecymogram-sekunda (system HUS).
- 500 gramów (g) = 1 dżin w chińskich jednostkach miary.
Litr (pisownia międzynarodowa) lub litr (pisownia amerykańska), symbole SI L i l. Litr jest metryczną jednostką objętości. Jest równy 1 decymetrowi sześciennemu (dm3), 1000 centymetrom sześciennym (cm3) lub 0,001 metra sześciennego (m3). Decymetr sześcienny (lub litr) zajmuje objętość 10 cm × 10 cm × 10 cm (patrz rysunek), a zatem jest równy jednej tysięcznej metra sześciennego. Mililitr, symbol SI ml lub ml to centymetr sześcienny. Centymetr sześcienny (lub ml) zajmuje objętość 1 cm × 1 cm × 1 cm, a zatem jest równy jednej tysięcznej litra (1/1000).
Przeliczniki

Przeliczniki
- 1 kwarta imperialna = 1,1365225 l.
- 1kwarta amerykańska = 0,946352946 L.
- 1 pinta imperialna = 0,56826125 L.
- 1 pinta amerykańska = 0,473176473 L.
- 1 galon imperialny =4,54609 l.
- 1galon amerykański = 3,785411784 L.
- 1 stopa sześcienna = 28,316846592 L.
- 1 cal sześcienny = 0,016387064 L.
- 1 imperialna uncja płynu = 28,4130625 ml.
- 1 uncja amerykańska= 29,5735295625 ml.
Gramy można łatwo zamienić na mililitry wedługponiższego wzoru.
V = m / ρ.
gdzie m - masa substancji, g; ρ - gęstość substancji, g/ml; V - objętość substancji.
Zgodnie z tym wzorem można zamienić każdą substancję na objętość i odwrotnie. Na przykład masz20 g rtęci (Hg) i chcesz obliczyć jej masę. ρ (gęstość) rtęci wynosi 13,5 g/ml, stąd
Zgodnie z tym wzorem można zamienić każdą substancję na objętość i odwrotnie. Na przykład masz20 g rtęci (Hg) i chcesz obliczyć jej masę. ρ (gęstość) rtęci wynosi 13,5 g/ml, stąd
V(Hg) = 20 g / 13,5 g/ml = 1,48 ml
1,48 ml to objętość 20 g rtęci.
Co to są mole?
Mol, symbol mol, n, jest jednostką ilości substancji w Międzynarodowym Układzie Jednostek Miar (SI). Ilość substancji jest miarą tego, ile elementarnych jednostek danej substancji znajduje się w obiekcie lub próbce (w dowolnej substancji). Mola definiuje się jako zawierającego dokładnie 6,02214085774 × 10²³ cząsteczek (atomów, cząsteczek, jonów, elektronów lub innych obiektów). Na przykład, 10 moli wody (związek chemiczny H2O) i 10 moli rtęci (pierwiastek chemiczny Hg) zawiera równe ilości substancji, a rtęć zawiera dokładnie jeden atom na każdą cząsteczkę wody, mimo że obie mają różne objętości i różne masy. Tak czy inaczej, to całkiem sporo, prawda? To jestpowód, dla którego wygodniej jest wiedzieć, jak przeliczyć gramy na mole zamiast gramów na liczbę atomów.
Czym jest masa molowa?
Masa molowa jest cechą charakterystyczną substancji, stosunkiem masy substancji do jej ilości. Liczbowo jest równa masie 1 mola substancji, czyli masa substancji zawiera liczbę cząsteczek równą liczbie Avogadro. Masa molowa, wyrażona w g/mol, liczbowo pokrywa się z masą cząsteczkową, wyrażoną w r.a.m. i względną masą atomową. Istnieje jednak różnica między masą molową a masą cząsteczkową, są one równe tylko liczbowo i różnią się wymiarami.
Na przykład masa molowa tlenu jako pierwiastka M(O) = 16 g/mol, ale jako prostej substancji składającej się z cząsteczek O2 = 32 g/mol.
Masy molowe złożonych cząsteczek można określić, sumując masy molowe ich elementów składowych. Na przykład masa cząsteczkowa wody H2O wynosi.
Na przykład masa molowa tlenu jako pierwiastka M(O) = 16 g/mol, ale jako prostej substancji składającej się z cząsteczek O2 = 32 g/mol.
Masy molowe złożonych cząsteczek można określić, sumując masy molowe ich elementów składowych. Na przykład masa cząsteczkowa wody H2O wynosi.
M(H2O) = 2 x M(H) + M(O) = 2 x 1 g/mol + 16 g/mol = 18 g/mol.
Jak zamienić mole na gramy i odwrotnie?
Aby poprawnie oszacować liczbę moli, n, substancji o określonej masie, m, (w gramach), należy postępować zgodnie ze wzorem gramów na mole.
n = m / M.
gdzie: M - masa molowa tego materiału. Jednostką jest zazwyczaj g/mol; m - masa substancji, g; n - mole substancji, mol.
Na przykład masz 100 g P2NP, który ma masę cząsteczkową 163,17 g/mol. Musisz obliczyć, ile to jest moli. Zgodnie z powyższym wzorem.
Na przykład masz 100 g P2NP, który ma masę cząsteczkową 163,17 g/mol. Musisz obliczyć, ile to jest moli. Zgodnie z powyższym wzorem.
n(P2NP) = 100 g / 163,17 g/mol = 0,6129 mola.
Inny przykład: do reakcji należy dodać 10 moli borohydratu sodu (NaBH4) o masie cząsteczkowej 37,83 g/mol i przeliczyć ją na gramy:
m(NaBH4) = 10 moli x 37,83 g/mol = 378,3 g.
Jak liczyć odczynniki?
Otworzyłeś podręcznik syntezy i zdałeś sobie sprawę, że potrzebujesz znacznie mniejszej lub większej skali syntezy. Jesteś zdezorientowany liczbami i nie wiesz, jak przeliczyć je na swoją skalę? Istnieje wyjaśnienie.
Jeśli chcesz zwiększyć skalę syntezy i jesteś pewien, że jest to możliwe zgodnie z zależnością liniową, wystarczy pomnożyć wszystkie ilości odczynników przez ten sam indeks. Otrzymasz ilości odczynników dla swojej skali syntezy i nie musisz pytać o to żadnego eksperta!
Przykład: chcesz przeprowadzić syntezę amfetaminy za pomocą NaBH4/CuCl2 i musisz wziąć 1000 g P2NP do tej syntezy zgodnie z instrukcją z forum BB. Chcesz przeprowadzić syntezę 150 g P2NP. Algorytm jest następujący.
Jeśli chcesz zwiększyć skalę syntezy i jesteś pewien, że jest to możliwe zgodnie z zależnością liniową, wystarczy pomnożyć wszystkie ilości odczynników przez ten sam indeks. Otrzymasz ilości odczynników dla swojej skali syntezy i nie musisz pytać o to żadnego eksperta!
Przykład: chcesz przeprowadzić syntezę amfetaminy za pomocą NaBH4/CuCl2 i musisz wziąć 1000 g P2NP do tej syntezy zgodnie z instrukcją z forum BB. Chcesz przeprowadzić syntezę 150 g P2NP. Algorytm jest następujący.
1. Podziel 1000 g opisanej w instrukcji ilości głównego prekursora P2NP przez 150 g, a otrzymasz niezbędny wskaźnik 6,67.
2. Podzielwszystkie ilości odczynników przez 6,67, a osiągniesz swój cel.
Wprzypadku konieczności zwiększenia obciążenia syntezy z 1000 g P2NP do 2500 g, należy postępować zgodnie z poniższymi instrukcjami.
1. Podziel 2500 g P2NP przez 1000 g, a otrzymasz wskaźnik 2,5.
2. Pomnóżwszystkie odczynniki przez 2,5, a osiągniesz swój cel.
Jak policzyć wydajność reakcji?
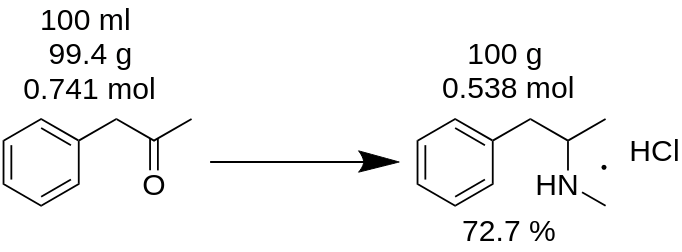
Przeprowadziłeś syntezę chlorowodorku metamfetaminy ze 100 ml P2P i otrzymałeś 100 g produktu. Myślisz, że uzyskałeś 100% wydajność? To błąd!
Przykład.
Przykład.
Przede wszystkim należy policzyć masę P2P, który został użyty do tej syntezy.
m(P2P) = 100 ml / 1,006 = 99,4 g
Następnie należy policzyć, ile moli brakującego odczynnika (P2P w tym przykładzie) bierze udział w reakcji.
n(P2P) = 99,4 g / 134,178 g/mol = 0,741 mola.
Brak reagenta to reagent, który bierze udział w reakcji i który ma najmniejszą ilość moli. Na przykład, w reakcji redukcyjnego aminowania P2P do metamfetaminy, trzeba wziąć 1 mol P2P i ~3,5 mola metyloaminy. P2P jest brakującym reagentem w tej reakcji.
Zgodnie z bilansem reakcji, 1 mol P2P daje 1 mol chlorowodorku metamfetaminy. Stąd 0,741 mola P2P daje 0,741 mola chlorowodorku metamfetaminy (MH), czyli
Zgodnie z bilansem reakcji, 1 mol P2P daje 1 mol chlorowodorku metamfetaminy. Stąd 0,741 mola P2P daje 0,741 mola chlorowodorku metamfetaminy (MH), czyli
m(MH) = 0,741 mola x 185,69 g/mol = 137,56 g.
gdzie 185,69 g/mol to masa cząsteczkowa chlorowodorku metamfetaminy.
Znany jako wydajność teoretyczna. Wydajność teoretyczna to ilość substancji, którą należy uzyskać w wyniku reakcji. Dlatego można policzyć wydajność reakcji na podstawietego teoretycznego wyniku.
Znany jako wydajność teoretyczna. Wydajność teoretyczna to ilość substancji, którą należy uzyskać w wyniku reakcji. Dlatego można policzyć wydajność reakcji na podstawietego teoretycznego wyniku.
Wydajność, % = (m(teoria)*100)/m(praktyka),
Wydajność (MH) = (100 g * 100) / 137,56 = 72,7%.
Wydajność (MH) = (100 g * 100) / 137,56 = 72,7%.
Jak widać, rzeczywista wydajność 72,7% naprawdę różni się od wydajności 100%, która została błędnie obliczona na podstawie masy reakcyjnej. Odgrywa toznaczącą rolę w produkcji każdej substancji.
Last edited:
