- Joined
- Apr 29, 2023
- Messages
- 78
- Reaction score
- 43
- Points
- 18
PPA HIPOFOSFOROSO E IODO =D ANFETAMINA OU USÁ-LO PARA FAZER 4 METILAMINOREX
InformaçõesbásicasSegurançaPreçoUtilizaçãoPreparaçãoProdutos ematérias-primasEspectroRelacionados

ChemicalBook CAS DataBase List Fenilpropanolamina
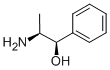
A fenilpropanolamina (PPA) é uma amina simpaticomimética de ação mista semelhante à efedrina. O seu principal mecanismo de ação é através do agonismo a-adrenérgico direto, mas também se verifica uma estimulação indireta da libertação de norepinefrina. Em novembro de 2000, o Comité Consultivo de Medicamentos Isentos de Prescrição da Food and Drug Administration (FDA) dos EUA determinou que existe uma associação significativa entre o PPA e o AVC hemorrágico e recomendou que o PPA não fosse considerado seguro para utilização sem receita médica. Nessa altura, foi enviada uma carta aos fabricantes solicitando a remoção voluntária do PPA dos seus produtos. Mais tarde, em 2005, a FDA publicou uma monografia final provisória para os produtos que contêm PPA, propondo o estatuto de categoria II (geralmente não reconhecido como seguro e eficaz). Até à data, não foi publicada nenhuma monografia final; no entanto, todos os fabricantes retiraram o PPA dos seus produtos.
Origem
Propadrine, MSD, EUA, 1941
Utilizações
A norefedrina, também designada por fenilpropanolamina (PPA), é uma forma sintética do alcaloide efedrina. Utilizada no tratamento da incontinência urinária em cães e gatos; descongestionante nasal. Após relatos da ocorrência de hemorragia intracraniana e outros efeitos adversos, incluindo várias mortes, a PPA deixou de ser vendida nos EUA e no Canadá.
Utilizações
Excitação do sistema nervoso central
Utilizações
O PPA era utilizado como descongestionante nasal e como anorexígeno. Estudos demonstraram benefícios em humanos para a incontinência urinária, e o PPA ainda é utilizado em medicina veterinária para este fim.
Definição
ChEBI: A (-)-norefedrina é uma anfetamina propilbenzeno substituída por um grupo hidroxi na posição 1 e por um grupo amino na posição 2 (estereoisómero 1R,2S). Trata-se de um alcaloide vegetal. Desempenha um papel de metabolito vegetal. É um membro das anfetaminas e um alcaloide de fenetilamina.
Processo de fabrico
Numa via descrita na Patente dos EUA 2.151.517, 10,7 kg de benzaldeído técnico são vigorosamente agitados com uma solução de 11,0 kg de bissulfito de sódio em 50,0 litros de água até que a formação do produto de adição esteja completa. Simultaneamente, 8,25 kg de nitroetano são dissolvidos numa solução de 4,5 kg de soda cáustica em 20,0 litros de água e a solução quente resultante é adicionada, com agitação vigorosa, ao magma de bissulfito de sódio de benzaldeído. A mistura é agitada durante 30 minutos e deixada em repouso durante a noite.
A parte aquosa da mistura é agora extraída da camada sobrenadante de fenilnitropropanol oleoso e substituída por uma solução fresca de 11,0 kg de bissulfito de sódio em 50,0 litros de água. A mistura de fenilnitropropanol e de solução de bissulfito é agitada vigorosamente durante 15 minutos, a fim de remover e recuperar pequenas quantidades de benzaldeído que não reagiu, e deixa-se estratificar de novo. Desta vez, o fenilnitropropanol é sifonado e filtrado para remover uma pequena quantidade de material resinoso. A solução aquosa de bissulfito de sódio remanescente é reagida com o benzaldeído, como descrito acima, tornando assim o processo contínuo.
O 1-fenil-2-nitropropanol assim obtido é um óleo incolor, de densidade 1,14 a 20°C, inodoro quando puro, volátil com vapor e que ferve a 150°-165°C sob uma pressão de 5 mm de mercúrio. É solúvel em álcool, éter, acetona, clorofórmio, tetracloreto de carbono, benzeno e ácido acético glacial. O rendimento do 1-fenil-2-nitropropanol obtido por este processo é de 17,1 a 17,7 kg.
O cloreto de hidrogénio é hidrogenado e convertido em cloridrato nas etapas seguintes. O cloreto de hidrogénio tem um ponto de fusão de 192°-194°C.
Numa via alternativa descrita na Patente US 3.028.429, a propiofenona pode ser reagida com um nitrito de alquilo para dar isonitrosopropiofenona, que é então hidrogenada e finalmente convertida em cloridrato.
nome comercial
A.g.multix;Acutrim;Adistop-f;Amertuss;Amplisiex;Am-tuss liq;Anorexin;Antiadipositum;Apoefedrina;e Aridose;Arm;Bifed-20;Bifetane;Biphetap;Blu-hist;Brocon cr;Bromanato;Bromepaph;Brometapp;Bronco-quintoxil;Cenadex;Chlor-rest;Cinturex;Cletanol;Codimal;Cofpac;Cold cap;Coldecon;Col-decon;Conex-grippe;Contop;Coricidin f;Corsym;Coryztime;Cremacoat;Dalca;Decidex;Decomine;Demazine;Deprecstop;Dexatrim;D-sinus;Efed ii;Eficol;Endal;Endecon;Endex;E-son;Espornade spansule;E-tapp 3;Exyphen;Factus;Fornagest;Fugoa n;Gardax;Ginsopan;Headway;Histade;Histatapp;Hsp 540;Ipercron;Kol-tac;Kontexin;Koryza;Leder;Lipo-sinahist;Lunerin;Mardram;Minus-x;Monatuss;Mucolyt-expecto;Nd-hist;Nectatussin;Neosoldana;Nexaam;Nobese;Norefedrina;Nornatane;Ornacol;Ornatos;Ornex;Pabron nose;Panacorn;Panadyl;Parhist;Partapp;Pholcolix spansule;Pneumidex;Polcimut;Profenade;Propagest;Reduzin;Rhindecon;Rhinergal;Rhinervert;Rhinicept;Rhinidrin;Rhinocap;Rinexin;Rinomar;Rinotussal;Rinurel lictus;Rinurel comprimidos;Rinutan;Rotabromophen;Rupton;Rynatapp;Rynex;Ryza-gesic;Sacietyl;Scotuss;Secron;Sinacin;Sinudan;Sinu-lets;Sinutab cough l;Spandecon;Srda;Sto-caps;Sulfa-probocon;Symptrol;Taviset;Tinaroc;Totolin;Tricon;Tri-congestic;Triogesic elixir;Triominic;Triotussic;Turbispan;Tussilene-dm;V cold;Veltane;Veltap;Vernate;Vistaminic;Voxin-pg;W 58;X 112 antiadipo;Zerinol;Partuss;Permatrim;Phenapap.
Função terapêutica
Descongestionante nasal, Anorexígeno
Organização Mundial de Saúde (OMS)
A fenilpropanolamina, uma amina simpaticomimética, está amplamente disponível em preparações de venda livre desde 1941. É um dos descongestionantes nasais mais frequentemente utilizados e é um ingrediente comum em preparações para redução de peso, embora tenham sido levantadas dúvidas sobre a sua utilidade nesta indicação. É também utilizado na incontinência de esforço. A sua utilização tem sido associada a uma elevação excessiva ocasional da tensão arterial, especialmente em indivíduos hipersensíveis.
Descrição geral
A fenilpropanolamina é o N-desmetilanálogo da efedrina e, portanto, tem muitas propriedades semelhantes. Sem o grupo N-metil, a fenilpropanolamina é ligeiramente mais polar e, portanto, não entra no SNC tão bem quanto a efedrina. Esta modificação dá origem a um agente que tem uma ação vasopressora ligeiramente superior e uma ação estimuladora central inferior à da efedrina. A sua ação como descongestionante nasal é mais prolongada do que a da efedrina. A fenilpropanolamina era um componente ativo comum nos inibidores de apetite e nos medicamentos para a tosse e a constipação da OTC até 2001, altura em que a Food and Drug Administration (FDA) recomendou a sua remoção desses medicamentos, porque os estudos mostraram um risco acrescido de acidente vascular cerebral hemorrágico em mulheres jovens que tomavam o medicamento.
Perfil de segurança
Moderadamente tóxico por via subcutânea. Quando aquecido até à decomposição, emite fumos muito tóxicos de NOx.
Avaliação da toxicidade
A ação primária do PPA é o agonismo a-adrenérgico direto, embora também provoque a libertação indireta de norepinefrina nos terminais nervosos simpáticos pós-ganglionares. A PPA também tem propriedades agonistas β fracas. A hipertensão resulta da vasoconstrição dos vasos sanguíneos periféricos mediada por α adrenérgicos. A bradicardia reflexa é comum. Os efeitos simpaticomiméticos podem produzir ansiedade, insónia, agitação, tremores, taquicardia e midríase.
MSDS|CAS|Base de dados CAS|Novosprodutos
Contacte-nos|Versão paracomputador
Livro de Química
InformaçõesbásicasSegurançaPreçoUtilizaçãoPreparaçãoProdutos ematérias-primasEspectroRelacionados

ChemicalBook CAS DataBase List Fenilpropanolamina

Fenilpropanolamina
- Nome do produtoFenilpropanolamina
- CAS14838-15-4
- Número CBCB22131029
- MFC9H13NO
- MW151.21
- EINECS238-900-2
- Ficheiro MOL14838-15-4.mol
Propriedades químicas
| Ponto de fusão | 101-101.5° |
| Ponto de ebulição | 273,23°C (estimativa aproximada) |
| Densidade | 1,0406 (estimativa aproximada) |
| Índice de refração | 1,5380 (estimativa) |
| pka | pKa 9.19(H2O,t =25±0.5,I=0.01)(Aproximado) |
| cor | Placas de H2O |
| FDA UNII | 33RU150WUN |
| Referência química NIST | Benzenemethanol, «alpha»-(1-aminoethyl)-, (r*,s*)-(.+/-.)-(14838-15-4) |
| Código ATC | R01BA01,R01BA51 |
| Sistema de Registo de Substâncias da EPA | Phenylpropanolamine (14838-15-4) |
Segurança
| Dados de Substâncias Perigosas | 14838-15-4(Dados de Substâncias Perigosas) |
| Toxicidade | LD50 scu-rat: 850 mg/kg JPETAB 85,199,45 |
Fenilpropanolamina Preço
Fenilpropanolamina Propriedades Químicas, Utilização, Produção
DescriçãoA fenilpropanolamina (PPA) é uma amina simpaticomimética de ação mista semelhante à efedrina. O seu principal mecanismo de ação é através do agonismo a-adrenérgico direto, mas também se verifica uma estimulação indireta da libertação de norepinefrina. Em novembro de 2000, o Comité Consultivo de Medicamentos Isentos de Prescrição da Food and Drug Administration (FDA) dos EUA determinou que existe uma associação significativa entre o PPA e o AVC hemorrágico e recomendou que o PPA não fosse considerado seguro para utilização sem receita médica. Nessa altura, foi enviada uma carta aos fabricantes solicitando a remoção voluntária do PPA dos seus produtos. Mais tarde, em 2005, a FDA publicou uma monografia final provisória para os produtos que contêm PPA, propondo o estatuto de categoria II (geralmente não reconhecido como seguro e eficaz). Até à data, não foi publicada nenhuma monografia final; no entanto, todos os fabricantes retiraram o PPA dos seus produtos.
Origem
Propadrine, MSD, EUA, 1941
Utilizações
A norefedrina, também designada por fenilpropanolamina (PPA), é uma forma sintética do alcaloide efedrina. Utilizada no tratamento da incontinência urinária em cães e gatos; descongestionante nasal. Após relatos da ocorrência de hemorragia intracraniana e outros efeitos adversos, incluindo várias mortes, a PPA deixou de ser vendida nos EUA e no Canadá.
Utilizações
Excitação do sistema nervoso central
Utilizações
O PPA era utilizado como descongestionante nasal e como anorexígeno. Estudos demonstraram benefícios em humanos para a incontinência urinária, e o PPA ainda é utilizado em medicina veterinária para este fim.
Definição
ChEBI: A (-)-norefedrina é uma anfetamina propilbenzeno substituída por um grupo hidroxi na posição 1 e por um grupo amino na posição 2 (estereoisómero 1R,2S). Trata-se de um alcaloide vegetal. Desempenha um papel de metabolito vegetal. É um membro das anfetaminas e um alcaloide de fenetilamina.
Processo de fabrico
Numa via descrita na Patente dos EUA 2.151.517, 10,7 kg de benzaldeído técnico são vigorosamente agitados com uma solução de 11,0 kg de bissulfito de sódio em 50,0 litros de água até que a formação do produto de adição esteja completa. Simultaneamente, 8,25 kg de nitroetano são dissolvidos numa solução de 4,5 kg de soda cáustica em 20,0 litros de água e a solução quente resultante é adicionada, com agitação vigorosa, ao magma de bissulfito de sódio de benzaldeído. A mistura é agitada durante 30 minutos e deixada em repouso durante a noite.
A parte aquosa da mistura é agora extraída da camada sobrenadante de fenilnitropropanol oleoso e substituída por uma solução fresca de 11,0 kg de bissulfito de sódio em 50,0 litros de água. A mistura de fenilnitropropanol e de solução de bissulfito é agitada vigorosamente durante 15 minutos, a fim de remover e recuperar pequenas quantidades de benzaldeído que não reagiu, e deixa-se estratificar de novo. Desta vez, o fenilnitropropanol é sifonado e filtrado para remover uma pequena quantidade de material resinoso. A solução aquosa de bissulfito de sódio remanescente é reagida com o benzaldeído, como descrito acima, tornando assim o processo contínuo.
O 1-fenil-2-nitropropanol assim obtido é um óleo incolor, de densidade 1,14 a 20°C, inodoro quando puro, volátil com vapor e que ferve a 150°-165°C sob uma pressão de 5 mm de mercúrio. É solúvel em álcool, éter, acetona, clorofórmio, tetracloreto de carbono, benzeno e ácido acético glacial. O rendimento do 1-fenil-2-nitropropanol obtido por este processo é de 17,1 a 17,7 kg.
O cloreto de hidrogénio é hidrogenado e convertido em cloridrato nas etapas seguintes. O cloreto de hidrogénio tem um ponto de fusão de 192°-194°C.
Numa via alternativa descrita na Patente US 3.028.429, a propiofenona pode ser reagida com um nitrito de alquilo para dar isonitrosopropiofenona, que é então hidrogenada e finalmente convertida em cloridrato.
nome comercial
A.g.multix;Acutrim;Adistop-f;Amertuss;Amplisiex;Am-tuss liq;Anorexin;Antiadipositum;Apoefedrina;e Aridose;Arm;Bifed-20;Bifetane;Biphetap;Blu-hist;Brocon cr;Bromanato;Bromepaph;Brometapp;Bronco-quintoxil;Cenadex;Chlor-rest;Cinturex;Cletanol;Codimal;Cofpac;Cold cap;Coldecon;Col-decon;Conex-grippe;Contop;Coricidin f;Corsym;Coryztime;Cremacoat;Dalca;Decidex;Decomine;Demazine;Deprecstop;Dexatrim;D-sinus;Efed ii;Eficol;Endal;Endecon;Endex;E-son;Espornade spansule;E-tapp 3;Exyphen;Factus;Fornagest;Fugoa n;Gardax;Ginsopan;Headway;Histade;Histatapp;Hsp 540;Ipercron;Kol-tac;Kontexin;Koryza;Leder;Lipo-sinahist;Lunerin;Mardram;Minus-x;Monatuss;Mucolyt-expecto;Nd-hist;Nectatussin;Neosoldana;Nexaam;Nobese;Norefedrina;Nornatane;Ornacol;Ornatos;Ornex;Pabron nose;Panacorn;Panadyl;Parhist;Partapp;Pholcolix spansule;Pneumidex;Polcimut;Profenade;Propagest;Reduzin;Rhindecon;Rhinergal;Rhinervert;Rhinicept;Rhinidrin;Rhinocap;Rinexin;Rinomar;Rinotussal;Rinurel lictus;Rinurel comprimidos;Rinutan;Rotabromophen;Rupton;Rynatapp;Rynex;Ryza-gesic;Sacietyl;Scotuss;Secron;Sinacin;Sinudan;Sinu-lets;Sinutab cough l;Spandecon;Srda;Sto-caps;Sulfa-probocon;Symptrol;Taviset;Tinaroc;Totolin;Tricon;Tri-congestic;Triogesic elixir;Triominic;Triotussic;Turbispan;Tussilene-dm;V cold;Veltane;Veltap;Vernate;Vistaminic;Voxin-pg;W 58;X 112 antiadipo;Zerinol;Partuss;Permatrim;Phenapap.
Função terapêutica
Descongestionante nasal, Anorexígeno
Organização Mundial de Saúde (OMS)
A fenilpropanolamina, uma amina simpaticomimética, está amplamente disponível em preparações de venda livre desde 1941. É um dos descongestionantes nasais mais frequentemente utilizados e é um ingrediente comum em preparações para redução de peso, embora tenham sido levantadas dúvidas sobre a sua utilidade nesta indicação. É também utilizado na incontinência de esforço. A sua utilização tem sido associada a uma elevação excessiva ocasional da tensão arterial, especialmente em indivíduos hipersensíveis.
Descrição geral
A fenilpropanolamina é o N-desmetilanálogo da efedrina e, portanto, tem muitas propriedades semelhantes. Sem o grupo N-metil, a fenilpropanolamina é ligeiramente mais polar e, portanto, não entra no SNC tão bem quanto a efedrina. Esta modificação dá origem a um agente que tem uma ação vasopressora ligeiramente superior e uma ação estimuladora central inferior à da efedrina. A sua ação como descongestionante nasal é mais prolongada do que a da efedrina. A fenilpropanolamina era um componente ativo comum nos inibidores de apetite e nos medicamentos para a tosse e a constipação da OTC até 2001, altura em que a Food and Drug Administration (FDA) recomendou a sua remoção desses medicamentos, porque os estudos mostraram um risco acrescido de acidente vascular cerebral hemorrágico em mulheres jovens que tomavam o medicamento.
Perfil de segurança
Moderadamente tóxico por via subcutânea. Quando aquecido até à decomposição, emite fumos muito tóxicos de NOx.
Avaliação da toxicidade
A ação primária do PPA é o agonismo a-adrenérgico direto, embora também provoque a libertação indireta de norepinefrina nos terminais nervosos simpáticos pós-ganglionares. A PPA também tem propriedades agonistas β fracas. A hipertensão resulta da vasoconstrição dos vasos sanguíneos periféricos mediada por α adrenérgicos. A bradicardia reflexa é comum. Os efeitos simpaticomiméticos podem produzir ansiedade, insónia, agitação, tremores, taquicardia e midríase.
Produtos de preparação e matérias-primas
Matérias-primasEspectro da fenilpropanolamina
14838-15-4, FenilpropanolaminaPesquisa relacionada
Enviar pedido de informaçãoMSDS|CAS|Base de dados CAS|Novosprodutos
Contacte-nos|Versão paracomputador
Livro de Química
