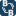Mohli byste hlouběji vysvětlit kompletní postup a věci srozumitelnější pro idioty, jako jsem já
A co je to médium? Skládá se z
Pokud tomu NEROZUMÍTE, nedělejte to. zatímco výroba LPAC je jako vaření piva DALŠÍ KROK.
tato sračka zahrnuje CYANID a BROMIN SPOLEČNĚ, aby se vyrobil kyanogen bromid je TOXICKÁ sračka.
Kyanogenní bromid vás může ovlivnit, když se ho nadýcháte.
průchodem přes kůži.
* Při kontaktu s ním může dojít k podráždění kůže a očí.
* Dýchání bromidu kyanatého může podráždit nos a oči.
hrdlo.
* Dýchání bromidu kyanatého může podráždit plíce.
způsobit kašel a/nebo dušnost. Vyšší
expozice mohou způsobit hromadění tekutiny v plicích.
(plicní edém), což představuje lékařskou pohotovost s vážnými následky.
dušností.
* Vysoká expozice kyanogenbromidu může způsobit smrtelnou
otravu kyanidem se zrudnutím obličeje, hrudníku a krve.
bolestí hlavy, nevolností, zvracením a slabostí,
zmatenost, závratě a problémy se spánkem. Vysoké hladiny
mohou způsobit křeče a smrt
Známá reakce hydrazidů s kyanogenbromidem, obvykle prováděná v přítomnosti hydrogenuhličitanu draselného nebo sodného,
poskytuje 2-amino-5-substituované-1,3,4-oxadiazoly. V posledních 10 letech byla tato reakce několikrát použita, zejména za účelem získání biologicky aktivních derivátů.....
Moje přezdívka je AZIDES... AZIDES go BOOM ...
Hydrazid se v přítomnosti kyseliny a dusitanu přemění na odpovídající
azid. Kyselinu hydrazovou lze vyrobit pouze z azidů a kyseliny (vody).
Viz
Jak nebezpečné je příliš nebezpečné? Pohled na azidovou chemii
Jak nebezpečné je příliš nebezpečné? Pohled na azidy
Chemie
Citujte: J. Org. Chem. 2022, 87, 11293-11295 Read Online
ACCESS Metriky a další doporučení k článkům
Všichni chemici by si měli být vědomi rizik spojených s jejich
práci a měli by zvážit, jak se odpovídajícím způsobem chránit
sebe a své kolegy před těmito riziky chránit. To si žádá
se nabízí otázka: Může být reakce natolik nebezpečná, že v obecném
účelové laboratoři, a to i za přítomnosti takovýchto bezpečnostních opatření,
je zbytkové riziko stále příliš vysoké? Tvrdíme, že ano, některé
reakce spadají do této kategorie: reakce, při nichž se používá stechiometrie
metrická množství kyseliny hydrazoové, ty, které vytvářejí přechodné
azidy kovů, a ty, které kombinují anorganický azid s
dichlormethanem.
Nedávný článek v tomto časopise, jehož autory jsou Gazvoda a kol.
popisuje postup přípravy triazolů z alkynů.
za použití stechiometrického azidu sodného, stechiometrické kyseliny a
katalytické mědi, po kterém následuje zpracování, které může zahrnovat
dichlormethan.1,2 Jako průmysloví chemici s desítkami let praxe
zkušenostmi s bezpečným rozšiřováním azidové chemie se cítíme povinni
podělit se s výzkumnou komunitou o naše tři hlavní bezpečnostní opatření.
obavy týkající se tohoto postupu.
V prvním případě se jedná o kombinaci azidu sodného a kyseliny.
vzniká kyselina hydrazoová. Kyselina hydrazoová je akutně toxická.
(LD50 u myší = 22 mg/kg)3 a silnou výbušninou; ve svém
je kyselina hydrazoová v čisté formě výbušnější než TNT a
řádově méně stabilní.4 První vědci, kteří izolovali TNT.
(Curtius a Radenhausen v roce 1891)5 , zjistili, že kyselina hydrazoová je nejvýznamnějším přírodním produktem.
že "výbuch 50 mg stačil k rozpadu třaskaviny".
na prach", a když následná dávka 700 mg
"samovolně explodovala", vážně zranila spoluautora.
(Radenhausena) a tlaková vlna z výbuchu
rozbila všechny skleněné nádoby v okolí. Neexistuje žádné bezpečné množství
při práci s čistou kyselinou hydrazoovou.
Zatímco zředěná kyselina hydrazoová je bezpečnější než čistá sloučenina,
je však stále velmi nebezpečná. V plynné fázi jsou směsi s
dusíkem obsahující více než 10 % HN3 jsou výbušné.4g V
ve vodě nebyla přesná hodnota stanovena, ale je to
obecně se uznává, že roztoky s obsahem >20 % hmotn. HN3 jsou
výbušné.6 Jedinečné riziko představuje kyselina hydrazoová v roztoku
spočívá v tom, že vzhledem k jejímu nízkému bodu varu (∼36 °C) může neúmyslné použití
odpaření a opětovná kondenzace zředěného, nevýbušného roztoku.
může vyústit v koncentrovaný, výbušný roztok (viz.
Obrázek 1.7 Je důležité si uvědomit, že kondenzované kapky
koncentrované kyseliny hydrazoové nepotřebují kyslík ani
ani jiskru, aby explodovaly (tj. tzv. "ohnivý trojúhelník" nefunguje).
neplatí).4b Sebemenší tření nebo náraz může způsobit výbuch.
vést k detonaci. Byly zaznamenány četné exploze
při práci s kyselinou hydrazoovou v roztoku, z nichž mnohé byly
bohužel vedlo ke zraněním a úmrtím8.
Obecně platí, že pokud mají být zředěné roztoky kyseliny hydrazoové
nebo skladovány, je nejlepším postupem přidání nízkovroucích roztoků do vodného roztoku.
(např. ether nebo pentan), aby se zředily veškeré páry a/nebo aby se zředila voda.
kondenzátu.4f Výpočty založené na teplotě a pH
může být nezbytné pochopit vhodnou bezpečnou koncentraci
6b,7b Kromě toho, pokud reakční systém obsahuje hydrazoovou kyselinu
nebo může vytvářet kyselinu hydrazoovou, je třeba zajistit kontinuální dusíkový reaktor.
aby se předešlo vzniku dusíku v hlavovém prostoru, může být použito dusíkové proplachování
kondenzaci a celý přístroj může být udržován v chodu.
nad 37 °C, aby se zajistilo, že kyselina hydrazoová nemůže kondenzovat.
Vrátíme-li se ke zveřejněnému postupu syntézy triazolů
Gazvoda et al., je druhým hlavním bezpečnostním problémem.
Zveřejněno: V roce 2007 byla v rámci projektu "Trhací zkoušky" zveřejněna nová studie: Září 2, 2022
Obrázek 1. Aplikace Henryho zákona a Antoinovy rovnice na 2,0
hm. roztoku HN3 ve vodě při 25 °C9.
Editorialpubs.acs.org/joc
Vydalo nakladatelství American Chemical v roce 2022
Society 11293
h
ttps://doi.org/10.1021/acs.joc.2c01402
J. Org. Chem. 2022, 87, 11293-11295Staženo prostřednictvím 73.170.156.34 dne 19. ledna 2024 v 22:51:42 (UTC).Možnosti legálního sdílení publikovaných článků
viz https://pubs.acs.org/sharingguidelines.
Kombinace solí mědi a azidu sodného. Byly nalezeny
více než tucet zdokumentovaných výbuchů způsobených
azidu měďnatého(I), azidu měďnatého(II) nebo neidentifikovaných směsí azidu měďnatého a azidu měďnatého.
mědi s azidem sodným nebo kyselinou hydrazoovou.10 Počet
Počet osob usmrcených při těchto explozích je nejméně 16. Neexistuje žádná
obecný osvědčený postup pro přidávání přechodných kovů do reakcí
obsahující anorganický azid nebo kyselinu hydrazoovou, protože takovýto
je mimořádně nebezpečný. Vysoce explozivní, nárazové, třecí,
a staticky citlivé azidové soli byly připraveny z Al, Ca,
Ti, V, Cr, Mn, Co, Ni, Cu, Zn, Mo, Pd, Ag, Cd, Sn, Sb, Te, Ba,
Pt, Au, Hg, Tl, Pb a Bi.4b Zejména azid mědi(II),
je údajně tak citlivý na nárazy, že jemně
rozrušení krystalické pevné látky, a to i pod vodou, vede k tomu, že se krystalická pevná látka
10b Z tohoto důvodu je nutné, aby průmyslová zařízení, která
připravují nebo používají anorganické azidy, velmi dbají na to, aby bylo zajištěno.
kovy byly přísně vyloučeny (tj. žádný kovový reaktor).
žádné kovové součásti, žádné kovové armatury, žádné kovové termočlánky, žádné kovy.
kovové naběračky nebo špachtle; dokonce i podlahové odtoky jsou zakryty, aby se zabránilo jejich poškození.
azid se nedostane do měděných trubek).4b,e
Poslední závažný bezpečnostní problém, který se při postupu vyskytl
Gazvoda et al. je použití dichlormethanu v postupu.
zpracování. Jak již bylo mnohokrát oznámeno.
kombinace anorganického azidu a dichlormethanu může způsobit.
vést k vysoce výbušnému diazidomethanu citlivému na náraz. Jak uvádí
s kyselinou hydrazolovou a azidem měďnatým, je tento nebezpečný
se podílela na řadě výbuchů.
včetně těch, které vedly k vážným zraněním11.
Na závěr bychom chtěli všem upřímně připomenout, že
laboratorní chemiky, že práce s anorganickým azidem vyžaduje
pečlivost. Obecně platí pravidlo, že kyseliny, halogenovaná rozpouštědla a
a kovy je třeba se přísně vyhýbat. Dále doporučujeme
autorům i recenzentům zachovat tyto závažné bezpečnostní obavy
na paměti při přípravě a hodnocení rukopisů. Všichni jsme
musíme přispět k šíření povědomí o extrémních rizicích, která hrozí
abychom se vyhnuli opakování tragických chyb z minulosti.
Daniel S. Treitler orcid.org/0000-0001-5375-4920
Simon Leung
■ INFORMACE O AUTOROVI
Kompletní kontaktní informace jsou k dispozici na adrese:
Poznámky
Názory vyjádřené v tomto úvodníku jsou názory autorů a
ne nutně názory ACS.
Oba autoři jsou zaměstnanci společnosti Bristol Myers Squibb. Bristol
Myers Squibb se podílela na přezkoumání a schválení tohoto článku.
rukopisu.
■ PODĚKOVÁNÍ
Autoři by rádi upřímně poděkovali Andreji Šemetovi a
Vladislavu Lisnyakovi za pomoc s překladem neanglických textů.
publikací. Kromě toho jsou autoři zavázáni Michaelu
Dummeldingerovi za pomoc s Henryho zákonem/Antoinovým zákonem.
rovnice pro kyselinu hydrazoovou v plynné fázi.
Autoři by také rádi poděkovali Greggu Feigelsonovi, Lakshmi
Narasimhanovi, Zacharymu Garletsovi a Trevoru Sherwoodovi za jejich spolupráci při přípravě a realizaci projektu.
za pečlivé posouzení rukopisu.
■ ODKAZY
(1) Jankovič , D.; Virant, M.; Gazvoda, M. Copper-Catalyzed Azide-.
Alkyne Cycloaddition of Hydrazoic Acid Formed In Situ from Sodium
Azidem sodným se získávají 4-monosubstituované-1,2,3-triazoly. J. Org. Chem. 2022,
87, 4018.
(2) Naše komunikace s profesorem Gazvodou podnítila
opravu původní publikace: Jankovič , D.; Virant, M.;
Gazvoda, M. Correction to "Copper-Catalyzed Azide-Alkyne Cyclo-
adici kyseliny hydrazoové vytvořené in situ z azidu sodného.
Affords 4-Monosubstituted-1,2,3-Triazoles". J. Org. Chem. 2022, 87,
8277.
(3) (a) Trout, D.; Esswein, E. J.; Hales, T.; Brown, K.; Solomon, G.;
Miller, M. Expozice a účinky na zdraví: hodnocení pracovníků v podniku
azidu sodného. Am. J. Ind. Med. 1996, 30, 343. (b)
Lewis, R. J., Sr., Ed. Sax's Dangerous Properties of Industrial Materials (Saxovy nebezpečné vlastnosti průmyslových materiálů);
Wiley & Sons, Inc: Hoboken, 2004.
(4) (a) Fedoroff, B. T.; Aaronson, H. A.; Sheffield, O. E.; Reese, E.
F.; Clift, G. D. Encyclopedia of Explosives and Related Items (Encyklopedie výbušnin a souvisejících předmětů); Picatinny
Arsenal: Dover, 1960. (b) Fair, H. D., Walker, R. F., Ed. Energetic
Materials Vol 1: Physics and Chemistry of the Inorganic Azides; Plenum
Press: New York, 1977. (c) Pepekin, V. I. Detonační parametr
criterion for explosives. Polym. J. Chem. 1981, 55, 1405. (d) Patnaik,
P. A Comprehensive Guide to the Hazardous Properties of Chemical (Komplexní průvodce nebezpečnými vlastnostmi chemických látek).
Substances; Van Nostrand Reinhold, 1992. (e) Peer, M. Dangerous
reakce. Azid sodný v průmyslové organické syntéze. Informace
Chimie. 1997, 98. (f) Urben, P. G., Ed. Bretherick's Handbook of
Reactive Chemical Hazards; Academic Press: Boston, 2007. (g) Wiss,
J.; Fleury, C.; Heuberger, C.; Onken, U. Explosion and Decom- (Výbuch a dekompozice).
position Characteristics of Hydrazoic Acid in Gas Phase. Org.
Process Res. Dev. 2007, 11, 1096.
(5) Curtius, T.; Radenhausen, R. For Knowledge about the
Azid vodíku. J. Prakt. Chem. 1891, 43, 207.
(6) (a) Kurbangalina, R. K.; Patskov, E. A.; Stesik, L. N.; Yakovleva,
G. S. Detonace kapalné kyseliny hydrazoové a jejích vodných roztoků.
Prikladnaya Mekhanika i Tekhnicheskaya Fizika 1970, 160. (b) Ertel,
D.; Schmieder, H.; Stollenwerk, A. H. The behaviour of hydrazoic acid
v roztocích procesu PUREX z hlediska bezpečnosti. Nukleare Entsorgung
1989, 107. (c) Ullmanova encyklopedie průmyslové chemie; VCH:
New York, 1989; svazek A13 "Kyselina hydrazoová a azidy".
(7) (a) Betterton, E. A.; Robinson, J. L. Henryho zákon: Henryho koeficient.
kyseliny hydrazoové. J. Air Waste Manage. Assoc. 1997, 47, 1216.
(b) González-Bobes, F.; Kopp, N.; Li, L.; Deerberg, J.; Sharma, P.;
Leung, S.; Davies, M.; Bush, J.; Hamm, J.; Hrytsak, M. Scale-up of
Azide Chemistry: A Case Study. Org. Process Res. Dev. 2012, 16, 2051.
(c) Treitler, D. S.; Leung, S.; Lindrud, M. Development and
Demonstration of a Safer Protocol for the Synthesis of 5-
aryltetrazolů z arylových nitrilů. Org. Process Res. Dev. 2017, 21, 460.
(8) (a) Curtius, T. Abstracts: On hydrazoic acid (azoimide). J. Am.
Chem. Soc. 1890, 12, 472. (b) Browne, A. W.; Lundell, G. E. F.
Anhydrous hydronitric acid. I. Elektrolýza roztoku draslíku.
trinitridu v kyselině hydronitronové. J. Am. Chem. Soc. 1909, 31, 435.
(c) Cooper-Key, A.; Crozier, T. H.; Thomas, R. A.; Watts, H. E.;
Malcolm, C. R. Fiftieth Annual Report of His Majesty's Inspectors of England.
Explosives; His Majesty's Stationary Office: London, 1926. (d) Sha-
piro, E. L. Hydrazoic acid explosion. Chemical & Engineering News
(Bloomfield, NJ) 1974, No. Jan, 14. (e) Sood, R. K.; Nya, A. E. Short
note on non-explosive distillation of HN3 (Poznámka k nevýbušné destilaci HN3). J. Therm. Anal. 1981, 20,
491. (f) Ministerstvo práce Spojených států amerických, Bezpečnost práce a ochrana zdraví při práci.
Health Administration. Nehoda: 699603 - Zaměstnanec usmrcený v bubnu.
Výbuch bubnu. Inspekce č. 102595436. Datum události 7. října 1995.
h
ttps://www.osha.gov/pls/imis/accidentsearch.accident_detail?id=
699603 (navštíveno 2022-05-27). (g) Crabbe, N. Sklo vložené do
v břiše studenta při výbuchu v laboratoři. Gainesville Sun (Gainesville, FL)
2012, 18. ledna
https://www.gainesville.com/story/sports/college/
2012/01/18/glass-embedded-in-students-chest-abdomen-in-lab-
explosion/64271845007/ (navštíveno 2022-05-27). (h) Taton, T. A.;
Partlo, W. E. Chemická bezpečnost: Nebezpečí výbuchu při syntéze
azidotrimethylsilanuChemical & Engineering News (Twin Cities, MN)
2014, 27. října.
(9) Poznámka: Tato fotografie byla zinscenována pro demonstrační účely; pozn. překl.
baňka ve skutečnosti neobsahuje roztok kyseliny hydrazoové.
Časopis The Journal of Organic Chemistry pubs.acs.org/joc Editorial
h
ttps://doi.org/10.1021/acs.joc.2c01402
J. Org. Chem. 2022, 87, 11293-11295
11294
(10) a) Dennis, L. M.; Isham, H. Hydronitric Acid, V. J. Am. Chem.
Soc. 1907, 29, 18. (b) Turrentine, J. W. Contributions to the Chem.
Electrochemistry of hydronitric acid and its salts [Elektrochemie kyseliny hydronitronové a jejích solí]. I. The corrosion of
některých kovů v roztoku trinitridu sodného. J. Am. Chem. Soc. 1911, 33,
803. (c) Hitch, A. R. Thermal decomposition of certain anorganic
trinitridů. J. Am. Chem. Soc. 1918, 40, 1195. (d) Cirulis, A. Copper
azid a jeho komplexy. Naturwissenschaften 1939, 27, 583. (e) Cirulis,
A. Výbušné vlastnosti Cu(N3)2. Zeitschrift fuer das Gesamte
Sciess- und Sprengstoffwesen 1943, 38, 42. (f) Becher, H. H. Use of
azidu sodného je nebezpečné. Naturwissenschaften 1970, 57, 671.
(g) Kabik, I.; Urman, S. Nebezpečí azidu měďnatého v rozbuškách. In
Sborník zápisů ze 14. semináře o bezpečnosti výbušnin, New.
Orleans, Louisiana - Department of Defense Explosive Safety Board,
1973. (h) Cowely, B. R.; Oughton, J. F. Detonation of heavy metal (Detonace těžkých kovů).
azidů. Chemistry & Industry 1973, 444. (i) Wear, J. O. CXX. Azide
Hazards with Automatic Blood Cell Counters (Nebezpečí u automatických počítadel krevních buněk). Journal of Chemical
Education (Safety in the Chemical Laboratory Supplement) 1975, 52,
A23. j) Pobiner, H. Chemical Safety: Hazard with sodium azide.
Chemical & Engineering News (Princeton, NJ) 1982, č. duben, 12.
(k) Bentur, Y.; Koren, G.; McGuigan, M.; Spielberg, S. P. An unusual
expozice kůže mědi; klinické a farmakokinetické hodnocení.
Journal of Toxicology: Clinical Toxicology 1988, 26, 371. (l) Sood, R.
K.; Alobi, N. O. Cupric Azide - A New Detonator for Mining. Global
Journal of Pure & Applied Sciences 1997, 3, 69. (m) Mortar Accident (Nehoda s minometem).
Mali; Nizozemská bezpečnostní rada: Haag, 2017.
(11) (a) Bretherick, L. Azide-halosolvent hazards (Nebezpečí spojená s azidem a rozpouštědlem). Chemical &
Engineering News (Dorset, Spojené království) 1986, č. prosinec, 22. (b) Peet, N.
P.; Weintraub, P. M. Explosion with sodium azide in DMSO-CH2Cl2 (Výbuch azidu sodného v DMSO-CH2Cl2).
Chemical & Engineering News (Cincinatti, OH) 1993, č. duben, 19.
(c) Hruby, V. J.; Boteju, L.; Li, G. Chemical Safety: Explosion with
azidem sodným. Chemical & Engineering News (Tucson, AZ) 1993,
No. October, 11. (d) Conrow, R. E.; Dean, W. D. Diazidomethane
výbuch. Org. Process Res. Dev. 2008, 12, 1285.
The Journal of Organic Chemistry pubs.acs.org/joc Editorial
h
ttps://doi.org/10.1021/acs.joc.2c01402
J. Org. Chem. 2022, 87, 11293-11295
11295
Dávalo tedy něco z toho smysl? POchopil jsi nebezpečí. POKUD ne, tato cesta není pro průměrnou včelu.