G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 3,299
- Solutions
- 3
- Reaction score
- 3,768
- Points
- 113
- Deals
- 1
Reaktioner med Grignard-reagenser.
Et Grignard-reagens har formlen RMgX, hvor X er et halogen, og R er en alkyl- eller arylgruppe (baseret på en benzenring). I forbindelse med dette emne antager vi, at R er en alkylgruppe (f.eks. BuMgBr). Grignard-reagenser fremstilles ved at tilsætte halogenalkanen til små stykker magnesium i en kolbe, der indeholder diethylether. Kolben forsynes med entilbagesvalingskondensator, og blandingen opvarmes over et vandbad i 20-30 minutter.
Alt skal være helt tørt, fordi Grignard-reagenser reagerer med vand (se nedenfor). Alle reaktioner, hvor man bruger Grignard-reagenset, udføres med den blanding, der fremkommer ved denne reaktion. Du kan ikke adskille den på nogen måde.
Grignard-reagenser ogvand.
Grignard-reagenser reagerer med vand og producerer alkaner. Dette er grunden til, at alt skal være meget tørt under forberedelsen ovenfor. For eksempel:Detuorganiske produkt, Mg(OH)Br, kaldes et "basisk bromid" og er en slags mellemting mellem magnesiumbromid og magnesiumhydroxid.
Generel reaktion mellem Grignards og carbonyl.
Reaktionerne mellem de forskellige slags carbonylforbindelser og Grignard-reagenser kan se ret komplicerede ud, men faktisk reagerer de alle på samme måde - det eneste, der ændrer sig, er de grupper, der er knyttet til carbon-oxygen-dobbeltbindingen. Det er meget nemmere at forstå, hvad der foregår, ved at se nærmere på det generelle tilfælde (ved at bruge "R"-grupper i stedet for specifikke grupper) - og så indsætte de forskellige reelle grupper, når det er nødvendigt.
Reaktionerne er stort set identiske med reaktionen med kuldioxid - det eneste, der er anderledes, er arten af det organiske produkt. I detførste trin tilføjer Grignard-reagenset over kulstof-oxygen-dobbeltbindingen.
Reaktionerne er stort set identiske med reaktionen med kuldioxid - det eneste, der er anderledes, er arten af det organiske produkt. I detførste trin tilføjer Grignard-reagenset over kulstof-oxygen-dobbeltbindingen.
Derefter tilsættes fortyndet syre for at hydrolysere det. (Jeg bruger den normalt accepterede ligning og ignorerer det faktum, at Mg(OH)Br vil reagere yderligere med syren).
Der dannes en alkohol. En af de vigtigste anvendelser af Grignard-reagenser er muligheden for nemt at fremstille komplicerede alkoholer. Hvilken slags alkohol du får, afhænger af den carbonylforbindelse, du startede med - med andre ord, hvad R og R' er.
Grignard-reagenser bruges i vid udstrækning til syntese af forskellige klasser af organiske forbindelser. Nogle eksempler er præsenteret nedenfor.
:
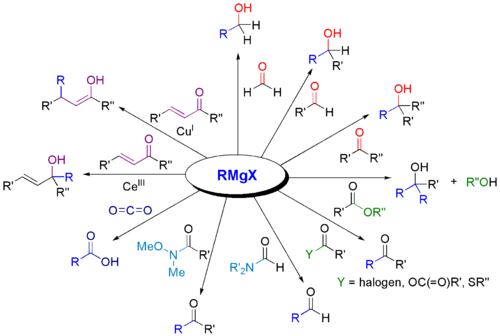
Reaktioner:
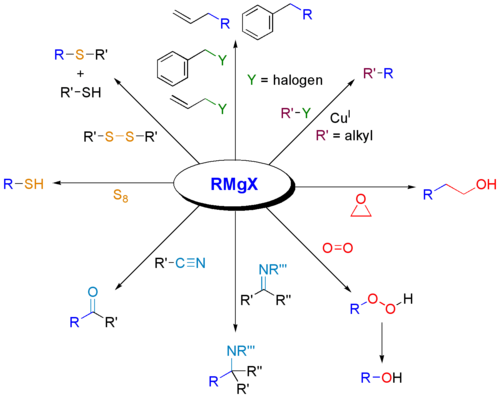
Hvorfor reagerer Grignard-reagenser med carbonyl?
Bindingen mellem kulstofatomet og magnesium er polær. Kulstof er mere elektronegativt end magnesium, og derfor trækkes det bindende elektronpar mod kulstoffet. Detefterlader kulstofatomet med en let negativ ladning.
Dobbeltbindingen mellem kulstof og ilt er også meget polær med en betydelig mængde positiv ladning på kulstofatomet. Grignard-reagenset kan derfor fungere som nukleofil på grund af tiltrækningen mellem den svagt negative ladning på kulstofatomet i Grignard-reagenset og den positive ladning på kulstoffet i carbonylforbindelsen. En nukleofiler et negativt (eller svagt negativt) atom, der angriber positive (eller svagt positive) centre i andre molekyler eller ioner.
Fremstilling afGrignard-reagenset, phenylmagnesiumbromid.
Grignard-reagenser spiller en afgørende rolle i organisk syntese. Disse forbindelser kan tilpasses til fremstilling af en lang række funktionelle grupper, og dannelsen og reaktionen af organomagnesiumderivater er en af de vigtigste anvendelser af alkylhalogenider i organisk syntese. Reaktionen mellem et halogenid og magnesium sker på overfladen af metallet og er formelt set en oxidation af metallet. Reaktionen udføres normalt i tørt etheropløsningsmiddel, idet æteren fungerer som en Lewis-base ved at opløse Grignard-reagenset og tillade det at diffundere væk fra metallet. Dannelsen af det organometalliske reagens kræver en aktiv overflade på metallet, og det kan være vanskeligt at få reaktionen i gang på grund af metaloxider på metaloverfladen. Det er ofte effektivt at slibe magnesium i en morter i et par minutter før brug for at få en ren overflade. Etandet nyttigt trick til at starte en reaktion er at tilsætte en lille krystal af jod til blandingen, som reagerer med magnesium og danner det meget reaktive salt magnesiumjodid (MgI2).
Fremgangsmåde.
Grignard-reagenset fremstilles ved først at forsyne en tør 250 ml rundbundet kolbe med et CaCl2-tørrerør. Det magnesium, der skal bruges (2 g = 0,082 mol magnesiumspåner), anbringes i kolben, calciumchloridrøret sættes direkte på, og kolben opvarmes grundigt med en stor varmekappe og en rheostat. Juster regulatoren til en stor varmekappe til indstilling '6', og opvarm kolben, indtil den er for varm til at røre ved med fingeren. Når kolben afkøles, strømmer der tør luft gennem calciumkloridet. Fjern varmekappen, og afkøl til stuetemperatur (kolben skal føles bare lidt varm i hånden eller køligere), før du fortsætter. Fjern tørrerøret til calciumchlorid, og hæld 15 ml absolut ether og 9 ml (13,5 g = 0,086 mol) brombenzen i 250-kolben med rund bund. Sæt CaCl2-tørrerøret på plads igen. Hvis der ikke er noget umiddelbart tegn på reaktion, skal du starte reaktionen ved at knuse nogle af magnesiumspånerne. Dette gøres ved at indsætte en tør rørestang med en flad ende og forsigtigt knuse et stykke magnesium fast mod bunden af kolben under væskeoverfladen og give stangen en drejende bevægelse. Når dette er gjort korrekt, bliver væsken let uklar, og der begynder at komme hurtige bobler på overfladen af det sammenpressede metal. På dette tidspunkt tilsættes yderligere 25 ml absolut ether, og der sættes en tilbagesvalingskondensator på kolben og CaCl2-røret på toppen af tilbagesvalingskondensatoren som vist på billedet.
Begynd ikke at lade vand løbe gennem kondensatoren, før æterdampene har fugtet fugen i toppen af kondensatoren. Hvis det er nødvendigt, kan du køle kolben ved at røre bunden af kolben med et isbad for at bremse reaktionen, men brug det ikke, medmindre det er nødvendigt. Det er kun nødvendigt, hvis der kommer æterdampe ud af toppen af tørrerøret. Hvis du er nødt til at køle reaktionen ned, skal du passe på ikke at bremse reaktionen for meget, for så kan den gå i stå og ikke starte igen, når isen fjernes. Ryst kolben kraftigt hvert 60. sekund. Når reaktionen begynder, kan den spontane kogning i den fortyndede blanding være langsom eller blive langsom. Hvis det er tilfældet, skal der tilsættes et par ekstra ml brombenzen til kolben. Reaktionen er afsluttet, når æteren holder op med at boble, og der kun er nogle få små rester af metal tilbage. Marker ether-niveauet i kolben. Under reaktionen skal du kontrollere, at mængden af ether ikke er faldet. Hvis det er tilfældet, skal du tilsætte mere tør ether. Da opløsningen af Grignard-reagenset forringes, når den står, skal det næste trin startes med det samme.
Kondensation af Grignard-reagenset med methylbenzoat.
Kondensation af Grignard-reagenset med methylbenzoat.
Bland 5 g (0,037 mol; 1,09 g/ml) methylbenzoat og 15 ml absolut ether i en skilletragt, og afkøl kolben med Grignard-reagensopløsningen kortvarigt i et isbad. Fjern tørrerøret, og indsæt en Claisen-adapter og en skilletragt i toppen af kondensatoren, som vist til højre. Kør methylbenzoatopløsningen ind dråbevis over en periode på ti minutter med kun den køling, der er nødvendig for at kontrollere den eksoterme reaktion. Produktsaltet udskilles som et hvidt fast stof under dette trin. Rør rundt i kolben med jævne mellemrum, indtil reaktionen er aftaget, og kolben har stuetemperatur. Gå direkte til næste trin.
Hydrolyse af tilsætningsproduktet.
Hydrolyse af tilsætningsproduktet.
Hæld forsigtigt reaktionsblandingen over i en 250 ml Erlenmeyer-kolbe, der indeholder 50 ml 10 % svovlsyre og ca. 25 g is. Brug et par ml almindelig (ikke-vandfri) ether og et par ml af den 10 % svovlsyre til at skylle reaktionskolben. Tilsæt disse skylninger til Erlenmeyer-kolben. Rør godt rundt for at fremme hydrolysen af tilsætningsforbindelsen; basiske magnesiumsalte omdannes til vandopløselige neutrale salte, og triphenylcarbinol fordeles i etherlaget. Det kan være nødvendigt med en ekstra mængde ether (almindelig), hvis dit oprindelige etherlag er blevet for lavt på grund af fordampning. Du kan stoppe på dette tidspunkt, hvis der ikke er tid nok til at færdiggøre den næste del. Opbevar den mærkede Erlenmeyer i hætten med en let monteret korkprop (ikke gummi). Proppen skal være så løs, at ethvert gastryk fra den udviklede brintgas frigives.
Når det uforbrugte Mg-metal kommer i kontakt med syren, vil der ske en kraftig udvikling af brintgas, og reaktionsblandingen kan skumme over, hvis tilsætningen sker for hurtigt.
Isolering af produktet.
Hvis dit etherlag har faste hvide krystaller, er disse produktkrystaller dannet, fordi noget af etherlaget er fordampet. Disse krystaller kan isoleres ved at hælde blandingen i en skilletragt gennem en glastragt med en lille prop af glasuld i stilken. Skyl krystallerne med en lille mængde etheropløsningsmiddel. For at isolere det resterende produkt skal du skylle Erlenmeyer-kolben, hvorfra du hældte den oprindelige opløsning, med et par ml almindelig ether og tilsætte dette til skilletragten. Ryst tragten, og sørg omhyggeligt for at udlufte den ophobede gas i tragten. Træk det vandige lag af. Ryst etherlaget med 10 % svovlsyre for yderligere at fjerne magnesiumsalte, og fjern svovlsyrelaget. Vask æterlaget med mættet natriumkloridopløsning for at fjerne vand, der er opløst i æteren. Fjern natriumkloridopløsningen. Mængden af væske, der bruges i disse vaskeoperationer, er ikke kritisk. Generelt er en mængde vaskevæske svarende til en tredjedel af etherens volumen tilstrækkelig. For at foretage den endelige tørring af etheropløsningen hældes etherlaget ud af halsen på skilletragten og over i en Erlenmeyer-kolbe, der tilsættes ca. 5 g vandfrit natriumsulfat i granulatform, kolben hvirvles rundt fra tid til anden, og efter 5 minutter dekanteres æteren fra det faste tørremiddel over i en anden ren, tør Erlenmeyer-kolbe. Tilsæt 25 ml ligroin til æteropløsningen, og luk kolben med en korkprop. Lad blandingen stå natten over eller indtil næste laboratorieperiode. Efter henstand bør der være dannet krystaller af triphenylcarbinol. Den største urenhed bifenyl skal forblive opløselig i omkrystallisationsopløsningsmidlet. Filtrer krystallerne ved sugefiltrering, indtil de er tørre. Noter vægten af det isolerede produkt, og beregn udbyttet i %. Tag etsmeltepunkt.
Når det uforbrugte Mg-metal kommer i kontakt med syren, vil der ske en kraftig udvikling af brintgas, og reaktionsblandingen kan skumme over, hvis tilsætningen sker for hurtigt.
Isolering af produktet.
Hvis dit etherlag har faste hvide krystaller, er disse produktkrystaller dannet, fordi noget af etherlaget er fordampet. Disse krystaller kan isoleres ved at hælde blandingen i en skilletragt gennem en glastragt med en lille prop af glasuld i stilken. Skyl krystallerne med en lille mængde etheropløsningsmiddel. For at isolere det resterende produkt skal du skylle Erlenmeyer-kolben, hvorfra du hældte den oprindelige opløsning, med et par ml almindelig ether og tilsætte dette til skilletragten. Ryst tragten, og sørg omhyggeligt for at udlufte den ophobede gas i tragten. Træk det vandige lag af. Ryst etherlaget med 10 % svovlsyre for yderligere at fjerne magnesiumsalte, og fjern svovlsyrelaget. Vask æterlaget med mættet natriumkloridopløsning for at fjerne vand, der er opløst i æteren. Fjern natriumkloridopløsningen. Mængden af væske, der bruges i disse vaskeoperationer, er ikke kritisk. Generelt er en mængde vaskevæske svarende til en tredjedel af etherens volumen tilstrækkelig. For at foretage den endelige tørring af etheropløsningen hældes etherlaget ud af halsen på skilletragten og over i en Erlenmeyer-kolbe, der tilsættes ca. 5 g vandfrit natriumsulfat i granulatform, kolben hvirvles rundt fra tid til anden, og efter 5 minutter dekanteres æteren fra det faste tørremiddel over i en anden ren, tør Erlenmeyer-kolbe. Tilsæt 25 ml ligroin til æteropløsningen, og luk kolben med en korkprop. Lad blandingen stå natten over eller indtil næste laboratorieperiode. Efter henstand bør der være dannet krystaller af triphenylcarbinol. Den største urenhed bifenyl skal forblive opløselig i omkrystallisationsopløsningsmidlet. Filtrer krystallerne ved sugefiltrering, indtil de er tørre. Noter vægten af det isolerede produkt, og beregn udbyttet i %. Tag etsmeltepunkt.
Syntese af psykoaktive stoffer med Grignard-reagens.
Grignard-reagenset bruges til syntese af flere overfladeaktive stoffer. For eksempel i syntesen af syntetiske cannabinoider til fastgørelse af en alkylgruppe til indol-nitrogenatomet (se JWH-018-synteseeksempel ). Reaktionen forløber ret hurtigt under milde forhold og kræver ikke opvarmning.
Den nukleofile tilsætning af Grignard-reagenset giver mulighed for en vis uspecifik og stereospecifik reaktion for at producere amfetamin ogdets forløber såsom phenyl-2-propanon (P2P).
Enanden metode til anvendelse af Grignard-reagenset er brug i forbindelse medmephedron (4-MMC)-syntese ved hjælp af 4-methylbenzaldehyd som udgangsmateriale.
Reaktionen af indolylmagnesiumiodid med substituerede alkylhalogenider, f.eks. nitrilerne Cl(CH2)nCN og chloracetyldiethylamid, for at give de tilsvarende 3-substituerede indoler er velkendt, selvom meget reaktive halogenider, såsom methyliodid og benzylchlorid, undertiden giver 1,3-disubstituerede indoler. Denne DMT-rute ermulig med hjælp fra Grignard-reagenset.
Ud over tidligere forskellige anvendelser anvendes denne populære tilgang i ketaminsyntese-trinnet i(o-chlorphenyl)-cyclopentylketon-fremstilling.
Konklusion.
Som du kan se, anvendes Grignard-reagens i vid udstrækning i organiske synteser og lægemiddelfremstilling delvist. Alkylmagnesiumhalogenider (også kaldet Grignard-reagenser) fungerer som nukleofiler, der angriber et elektrofilt kulstofatom for at danne en kulstof-kulstofbinding. Grignard-reaktionen er en vigtig metode til at skabe kulstof-kulstof-bindinger samt kulstof-heteroatom-bindinger. Denne liste over de mest populære reaktioner blandt hemmelige kemikere viser det enorme potentiale for anvendelse af Grignard-reagenser og udgør et stort forskningsfelt.
Last edited:
