- Joined
- Dec 27, 2022
- Messages
- 30
- Reaction score
- 81
- Points
- 18
Also gut, Leute! Es ist an der Zeit, etwas Wissen mit euch zu teilen. Ich werde eine Synthese beschreiben, die ich für Psilocin durchgeführt habe, komplett mit Fotos. Ich habe das hergestellte Psilocin verwendet und ein einfaches Pflaster entwickelt. Um die Permeation des Psilocins im Pflaster zu testen, haben wir eine Diffusionsapparatur verwendet, die ich zusammengebaut habe. Sie besteht aus mehreren Membranen, wobei ein 1 cm^2 großes Pflaster auf ein 1 cm^2 großes Stück frischer menschlicher Haut mit einer Dicke von 400 um (gespendet von einem Zentrum für Bauchdeckenstraffung) aufgebracht wird. Unter der Haut befindet sich ein konstanter Wasserstrom mit einem pH-Wert von 7,4 und Körpertemperatur. Das Diffusionsgerät ist in der Lage, eine Fraktion von 1 ml pro Stunde zu sammeln, die dann mittels LC-MS analysiert wird. Die Psilocinmenge in dem 1-ml-Fläschchen ergibt den Fluss (mg/h/cm^2). Dieser gibt an, wie viel Psilocin pro Stunde bei einer Pflastergröße von cm^2 passiert.
In der folgenden Publikation, Structure Elucidation and Spectroscopic Analysis of Chromophores Produced by Oxidative Psilocin Dimerization, wird das Thema näher erläutert, da Psilocin sehr instabil ist. Wenn sich das Dimer bildet, ist es mittels HPLC-Analyse und ATR-FTIR nicht nachweisbar, was seltsam ist. Dies führt dazu, dass Forschungsgruppen die Reinheit ihres Psilocins falsch einschätzen. Ich habe einen Weg gefunden, Psilocin im Pflaster zu stabilisieren.
Wie auch immer, fangen wir an! Ich habe jeden Schritt selbst gemacht, mit der Unterstützung meines Partners, der Chemieingenieur ist. Das war zu einer Zeit, als ich eine DEA-Lizenz nach Schedule 1 und 3 nicht nur für die Forschung, sondern auch für die Herstellung hatte.
Teil I (Psilocin-Synthese)
Schritt 1: Synthese von 3-[2-(Dimethylamino)-2-oxoacetyl]-1H-indol-4-yl Acetat
1a. Ein 2000-mL-Vierhalskolben mit rundem Boden wurde mit einem Überkopfrührer, einem J-Kem-Temperaturregler, einem 250-mL-Tropftrichter und einem Gummiseptum ausgestattet, durch das ein Überdruck von trockenemN2 eingeführt wurde. Das Septum wurde entfernt und der Kolben zu gleichen Teilen mit 1H-Indol-4-ylacetat (5; 50,1 g, 285 mmol, 1 Äquivalent)
und anhydischem Et2O (700 mL). Der Kolben wurde mit dem Septum wieder verschlossen und mit N2 gespült. Die Suspension wurde 10 Minuten lang gerührt und dann
30 min im Eiswasserbad auf 0 °C abgekühlt.

1b. Der Tropftrichter wurde mit einer Lösung von Oxalylchlorid (37,1 mL, 428 mmol, 1,5 equiv) in Et2O (60 mL) gefüllt. Die Oxalylchloridlösung wurde tropfenweise zugegeben, wobei die Temperatur bei oder unter 5 °C gehalten wurde, um die Bildung von Dimeren und anderen möglichen Nebenprodukten zu minimieren. Mit fortschreitender Zugabe bildete sich eine gelbe Aufschlämmung von 10. Nach Abschluss der Zugabe wurde die Mischung 4 Stunden lang gerührt.

1c. Nach dieser Zeit wurde Heptan (400 ml) zugegeben und das Gemisch 30 Minuten lang bei 0 °C gerührt. Der erhaltene gelbe Feststoff wurde rasch filtriert und nacheinander mit Heptan (2 × 300 mL) gespült, das im nächsten Schritt rasch verwendet wurde. . Eine 2,0-M-Lösung von Dimethylamin in THF (175 mL) wurde tropfenweise zugegeben, und zwar so schnell, dass die Temperatur unter 5 °C blieb, um Nebenreaktionen zu minimieren. Nachdem die
Nachdem die Zugabe abgeschlossen war, wurde Pyridin (46 mL) in THF (100 mL) tropfenweise zugegeben und die Mischung 60 Minuten lang gut gerührt. Heptan (600 mL) wurde zugegeben und der Kolbeninhalt über einen Büchnertrichter abfiltriert. Der filtrierte Rückstand wurde in einen Rundkolben überführt und deionisiertes H2O (1000 mL) zugegeben, 30 min gerührt und über einen Büchnertrichter filtriert. Der cremefarbene Feststoff wurde nacheinander 40 Minuten lang in EtOAc (600 ml) und Heptan (400 ml) trituiert. Die Aufschlämmung wurde über den Büchnertrichter filtriert und der Feststoff über Nacht im Ofen bei 40 °C getrocknet, um 6 als hellgelben Feststoff zu erhalten; Ausbeute: 66,1 g (81 %); mp 205-207 °C.



ATR-FTIR bestätigte die Synthese von 3-[2-(Dimethylamino)-2-oxoacetyl]-1H-indol-4-yl Acetat. Diese Verbindung kann bei 4C für mehrere Monate gelagert werden!
Schritt 2: Psilocin-Synthese
Schritt 2A: Ein 2000-mL-Vierhalskolben mit rundem Boden wurde mit einem Überkopfrührer, einem J-Kem-Temperaturregler, einem
250-mL-Tropftrichter und einem Gummiseptum, durch das ein Überdruck von trockenem N2 eingeführt wurde. Das Septum wurde entfernt und der
Kolben wurde nacheinander mit 3-[2-(Dimethylamino)-2-oxoacetyl]-1H-indol-4-yl-acetat (6; 31,5 g, 115 mmol) und 2-CH3-THF (1000
mL). Der Kolben wurde in ein Eisbad bei 0 °C getaucht und eine Lösung von 2,3 M LiAlH4 in 2-CH3-THF (140 mL, 322 mmol) wurde durch einen
durch den 250-mL-Tropftrichter zugegeben. Der Tropftrichter wurde mit zusätzlichem 2-CH3-THF (20 mL) gespült. Die LiAlH4-Lösung wurde tropfenweise zugegeben
zugegeben, um die Temperatur unter 20 °C zu halten. Nach der Zugabe wurde das Eiswasserbad entfernt und die Mischung 30 Minuten lang gerührt.
Die hellgelbe Lösung wurde mit einem Heizmantel bis zum Rückfluss (80 °C) erhitzt und färbte sich nach 3 h elfenbeinfarben.
An den Seiten des Rundkolbens wurde eine Ansammlung von gelben Feststoffen beobachtet



Schritt 2C. Der Heizmantel wurde entfernt, und der Kolben wurde auf 50 °C abgekühlt. Der Kolben wurde erneut
auf 20 °C abgekühlt. Die Reaktion wurde durch aufeinanderfolgende Zugabe von 3 Tropfen aq 1 M NaOH und 3 Tropfen entionisiertem H2O abgeschreckt. Das Gemisch
wurde mit THF (500 mL) verdünnt und 20 Minuten lang gerührt. Das Gemisch wurde über einen Büchner-Trichter filtriert und das Filtrat unter N2 gehalten.
Der Filterkuchen wurde mit 200 mL [10%ige Lösung von (7% Ammoniak in MeOH) in CH2Cl2] und THF (500 mL) schnell wieder aufgerührt. Die Filtrate
wurden dann vereinigt und konzentriert, um einen grünen Feststoff zu erhalten. Der Feststoff wurde mit 1:1 EtOAc/Heptan (50 mL) trituriert und dann über einen
Büchner-Trichter filtriert. Der dunkelgrüne Feststoff wurde über Nacht im Ofen bei 40 °C getrocknet, um trockenes Psilocin (7) als dunkelgrünen Feststoff zu erhalten; Ausbeute: 20,7
g (91%); mp 167-169 °C.
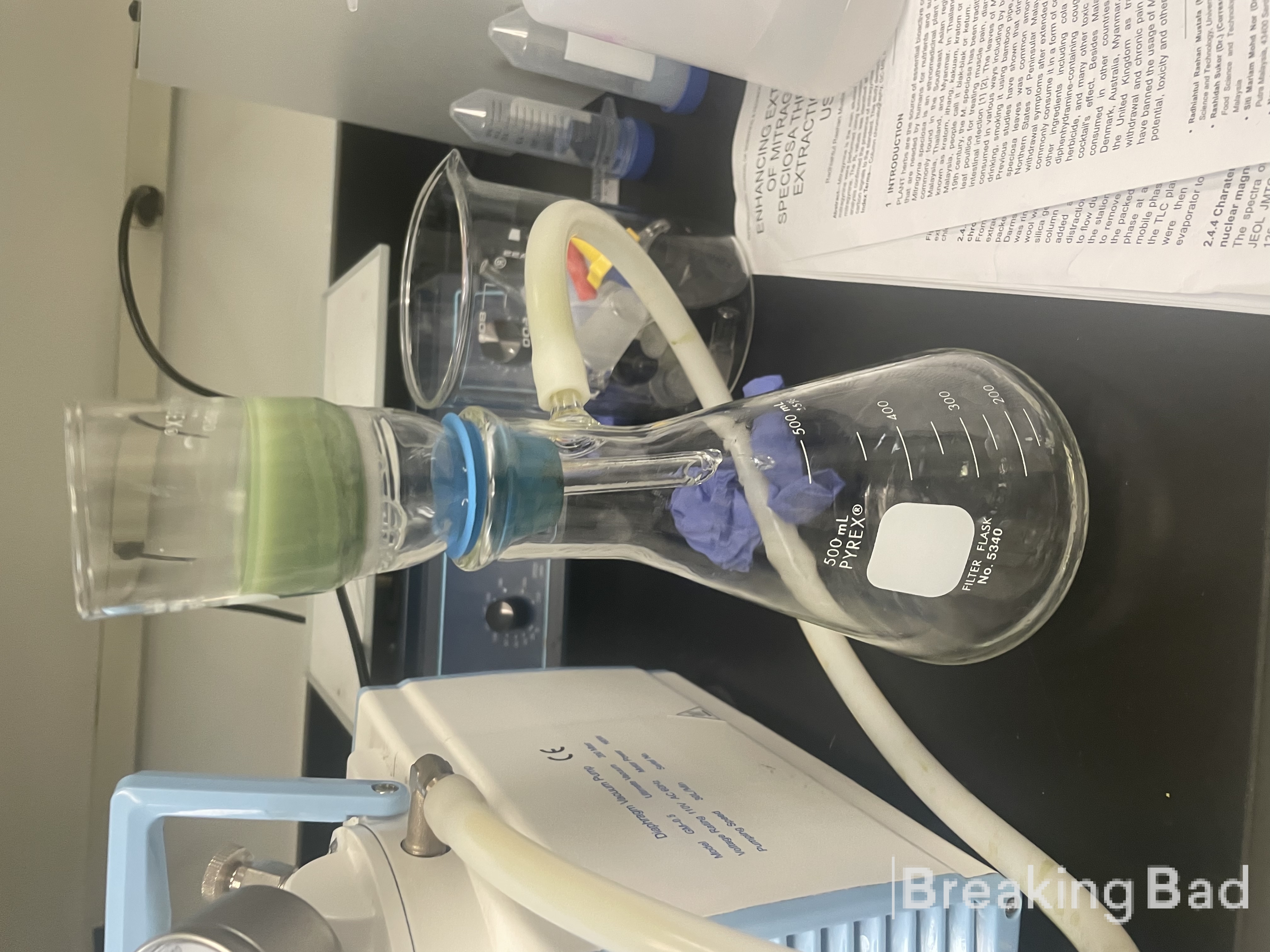


Psilocin wurde synthetisiert.
Teil II: Entwicklung eines transdermalen Psilocin-Pflasters und In-Vitro-Studie (ACHTUNG: SIE WERDEN FRISCHES MENSCHLICHES FLESH SEHEN, ES IST GROSS
Dann löse ich das Psilocin in einer firmeneigenen Acrylatpolymermischung (in Heptan) auf. Anschließend gieße ich die Lösung in eine Trennlinie und verwende ein Gießmesser, um die Klebeschicht auf 100 um zu bringen. Nach dem Trocknen bringe ich die Trägerschicht auf und stanze ein 1 cm^2 großes Pflaster aus. Dieses Pflaster wird für die In-vitro-Studie verwendet.
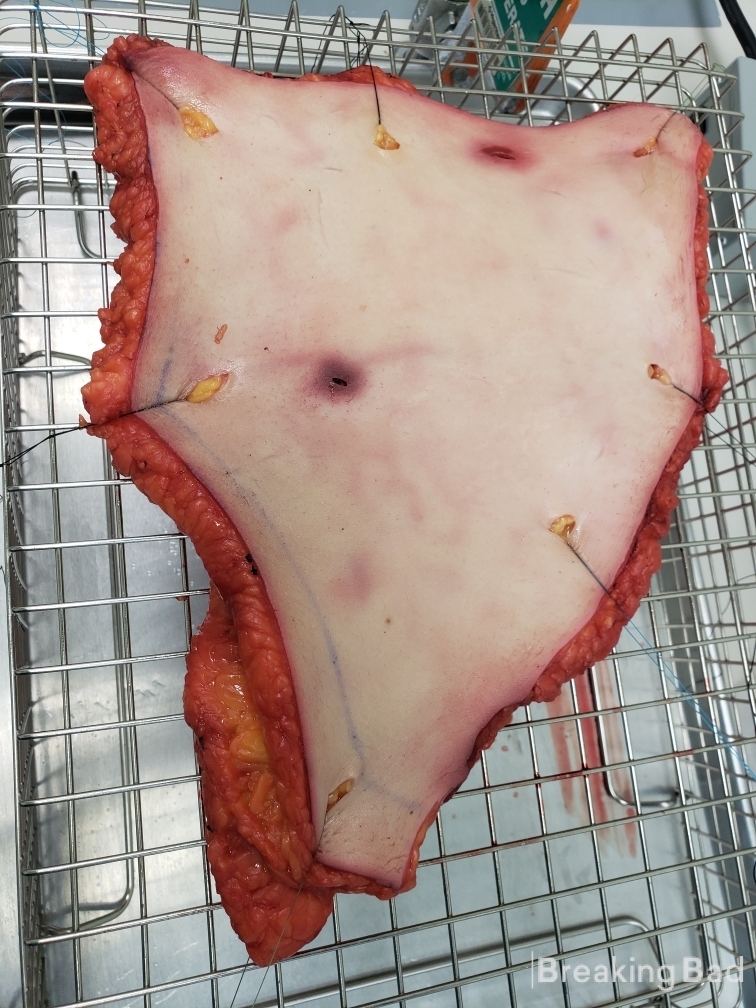
Das folgende Foto ist ein Schnappschuss des Diffusionsapparats (Pflaster auf der Haut mit darunter fließendem Wasser)

Viel Vergnügen!
In der folgenden Publikation, Structure Elucidation and Spectroscopic Analysis of Chromophores Produced by Oxidative Psilocin Dimerization, wird das Thema näher erläutert, da Psilocin sehr instabil ist. Wenn sich das Dimer bildet, ist es mittels HPLC-Analyse und ATR-FTIR nicht nachweisbar, was seltsam ist. Dies führt dazu, dass Forschungsgruppen die Reinheit ihres Psilocins falsch einschätzen. Ich habe einen Weg gefunden, Psilocin im Pflaster zu stabilisieren.
Wie auch immer, fangen wir an! Ich habe jeden Schritt selbst gemacht, mit der Unterstützung meines Partners, der Chemieingenieur ist. Das war zu einer Zeit, als ich eine DEA-Lizenz nach Schedule 1 und 3 nicht nur für die Forschung, sondern auch für die Herstellung hatte.
Teil I (Psilocin-Synthese)
Schritt 1: Synthese von 3-[2-(Dimethylamino)-2-oxoacetyl]-1H-indol-4-yl Acetat
1a. Ein 2000-mL-Vierhalskolben mit rundem Boden wurde mit einem Überkopfrührer, einem J-Kem-Temperaturregler, einem 250-mL-Tropftrichter und einem Gummiseptum ausgestattet, durch das ein Überdruck von trockenemN2 eingeführt wurde. Das Septum wurde entfernt und der Kolben zu gleichen Teilen mit 1H-Indol-4-ylacetat (5; 50,1 g, 285 mmol, 1 Äquivalent)
und anhydischem Et2O (700 mL). Der Kolben wurde mit dem Septum wieder verschlossen und mit N2 gespült. Die Suspension wurde 10 Minuten lang gerührt und dann
30 min im Eiswasserbad auf 0 °C abgekühlt.
1b. Der Tropftrichter wurde mit einer Lösung von Oxalylchlorid (37,1 mL, 428 mmol, 1,5 equiv) in Et2O (60 mL) gefüllt. Die Oxalylchloridlösung wurde tropfenweise zugegeben, wobei die Temperatur bei oder unter 5 °C gehalten wurde, um die Bildung von Dimeren und anderen möglichen Nebenprodukten zu minimieren. Mit fortschreitender Zugabe bildete sich eine gelbe Aufschlämmung von 10. Nach Abschluss der Zugabe wurde die Mischung 4 Stunden lang gerührt.
1c. Nach dieser Zeit wurde Heptan (400 ml) zugegeben und das Gemisch 30 Minuten lang bei 0 °C gerührt. Der erhaltene gelbe Feststoff wurde rasch filtriert und nacheinander mit Heptan (2 × 300 mL) gespült, das im nächsten Schritt rasch verwendet wurde. . Eine 2,0-M-Lösung von Dimethylamin in THF (175 mL) wurde tropfenweise zugegeben, und zwar so schnell, dass die Temperatur unter 5 °C blieb, um Nebenreaktionen zu minimieren. Nachdem die
Nachdem die Zugabe abgeschlossen war, wurde Pyridin (46 mL) in THF (100 mL) tropfenweise zugegeben und die Mischung 60 Minuten lang gut gerührt. Heptan (600 mL) wurde zugegeben und der Kolbeninhalt über einen Büchnertrichter abfiltriert. Der filtrierte Rückstand wurde in einen Rundkolben überführt und deionisiertes H2O (1000 mL) zugegeben, 30 min gerührt und über einen Büchnertrichter filtriert. Der cremefarbene Feststoff wurde nacheinander 40 Minuten lang in EtOAc (600 ml) und Heptan (400 ml) trituiert. Die Aufschlämmung wurde über den Büchnertrichter filtriert und der Feststoff über Nacht im Ofen bei 40 °C getrocknet, um 6 als hellgelben Feststoff zu erhalten; Ausbeute: 66,1 g (81 %); mp 205-207 °C.
ATR-FTIR bestätigte die Synthese von 3-[2-(Dimethylamino)-2-oxoacetyl]-1H-indol-4-yl Acetat. Diese Verbindung kann bei 4C für mehrere Monate gelagert werden!
Schritt 2: Psilocin-Synthese
Schritt 2A: Ein 2000-mL-Vierhalskolben mit rundem Boden wurde mit einem Überkopfrührer, einem J-Kem-Temperaturregler, einem
250-mL-Tropftrichter und einem Gummiseptum, durch das ein Überdruck von trockenem N2 eingeführt wurde. Das Septum wurde entfernt und der
Kolben wurde nacheinander mit 3-[2-(Dimethylamino)-2-oxoacetyl]-1H-indol-4-yl-acetat (6; 31,5 g, 115 mmol) und 2-CH3-THF (1000
mL). Der Kolben wurde in ein Eisbad bei 0 °C getaucht und eine Lösung von 2,3 M LiAlH4 in 2-CH3-THF (140 mL, 322 mmol) wurde durch einen
durch den 250-mL-Tropftrichter zugegeben. Der Tropftrichter wurde mit zusätzlichem 2-CH3-THF (20 mL) gespült. Die LiAlH4-Lösung wurde tropfenweise zugegeben
zugegeben, um die Temperatur unter 20 °C zu halten. Nach der Zugabe wurde das Eiswasserbad entfernt und die Mischung 30 Minuten lang gerührt.
Die hellgelbe Lösung wurde mit einem Heizmantel bis zum Rückfluss (80 °C) erhitzt und färbte sich nach 3 h elfenbeinfarben.
An den Seiten des Rundkolbens wurde eine Ansammlung von gelben Feststoffen beobachtet
Schritt 2C. Der Heizmantel wurde entfernt, und der Kolben wurde auf 50 °C abgekühlt. Der Kolben wurde erneut
auf 20 °C abgekühlt. Die Reaktion wurde durch aufeinanderfolgende Zugabe von 3 Tropfen aq 1 M NaOH und 3 Tropfen entionisiertem H2O abgeschreckt. Das Gemisch
wurde mit THF (500 mL) verdünnt und 20 Minuten lang gerührt. Das Gemisch wurde über einen Büchner-Trichter filtriert und das Filtrat unter N2 gehalten.
Der Filterkuchen wurde mit 200 mL [10%ige Lösung von (7% Ammoniak in MeOH) in CH2Cl2] und THF (500 mL) schnell wieder aufgerührt. Die Filtrate
wurden dann vereinigt und konzentriert, um einen grünen Feststoff zu erhalten. Der Feststoff wurde mit 1:1 EtOAc/Heptan (50 mL) trituriert und dann über einen
Büchner-Trichter filtriert. Der dunkelgrüne Feststoff wurde über Nacht im Ofen bei 40 °C getrocknet, um trockenes Psilocin (7) als dunkelgrünen Feststoff zu erhalten; Ausbeute: 20,7
g (91%); mp 167-169 °C.
Psilocin wurde synthetisiert.
Teil II: Entwicklung eines transdermalen Psilocin-Pflasters und In-Vitro-Studie (ACHTUNG: SIE WERDEN FRISCHES MENSCHLICHES FLESH SEHEN, ES IST GROSS
Dann löse ich das Psilocin in einer firmeneigenen Acrylatpolymermischung (in Heptan) auf. Anschließend gieße ich die Lösung in eine Trennlinie und verwende ein Gießmesser, um die Klebeschicht auf 100 um zu bringen. Nach dem Trocknen bringe ich die Trägerschicht auf und stanze ein 1 cm^2 großes Pflaster aus. Dieses Pflaster wird für die In-vitro-Studie verwendet.
Das folgende Foto ist ein Schnappschuss des Diffusionsapparats (Pflaster auf der Haut mit darunter fließendem Wasser)
Viel Vergnügen!


