Brain
Expert Pharmacologist
- Joined
- Jul 6, 2021
- Messages
- 304
- Reaction score
- 332
- Points
- 63
Das zwanghafte Verlangen, nach dem Konsum von Cannabis zu essen, zu essen und nochmals zu essen, auch wenn der Magen es nicht zulässt, ist sowohl ein Fluch als auch eine Erlösung. Es hängt alles davon ab, zu welchem Zweck man diese Pflanze verwendet. Und der neu entdeckte Mechanismus der Cannabinoid-Wirkung auf das Gehirn entpuppt sich als paradox: Der unbezähmbare Appetit wird durch die Stimulierung von Hypothalamus-Neuronen verursacht, die normalerweise das Sättigungsgefühl auslösen. Auch hier waren die "bakteriellen Eindringlinge" - die Mitochondrien - beteiligt.
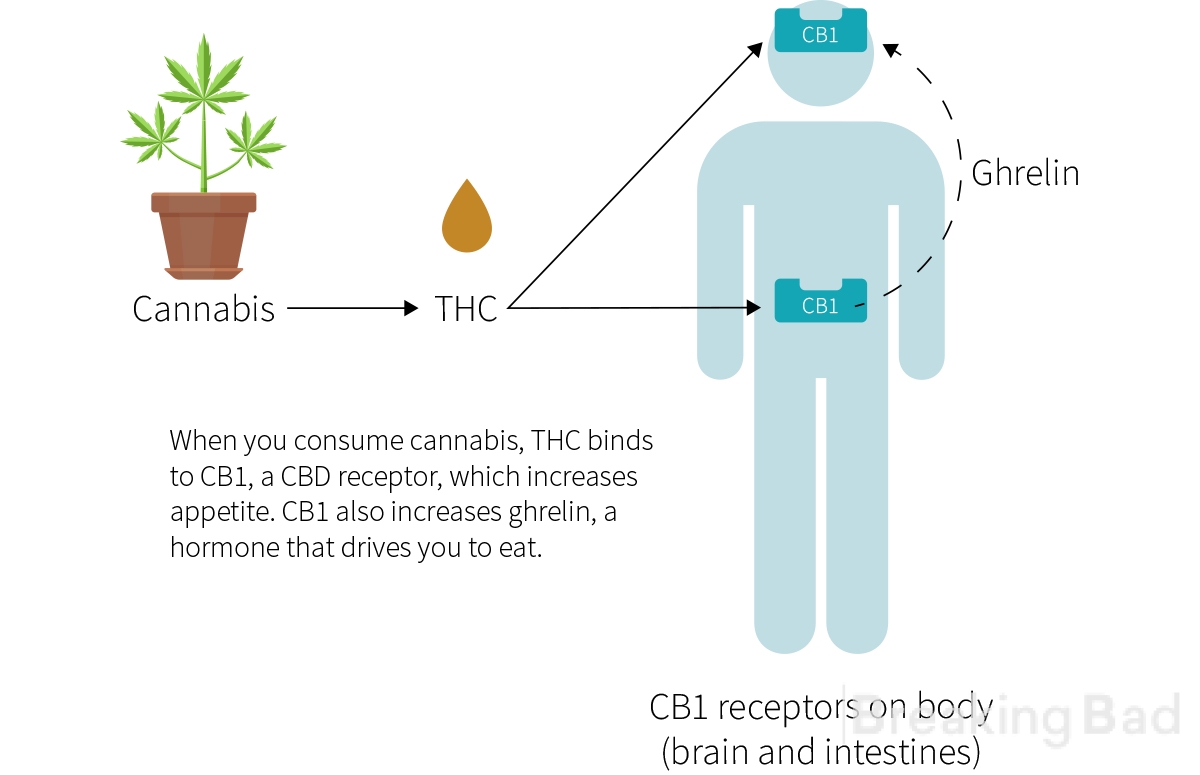

Diese Wirkung von Cannabis, die im Volksmund als "Heißhunger" bezeichnet wird, ist allgemein bekannt und wird sogar in der Medizin eingesetzt, um den Appetit von Patienten zu steigern, die aufgrund einer schmerzhaften Anorexie oder einer besonders toxischen Krebsbehandlung an Gewicht verlieren. Die psychoaktiven Substanzen in Cannabis, die Cannabinoide, verursachen diese Wirkung. Die aktivste und am besten untersuchte Substanz ist das Terpenoid Delta-9-Tetrahydrocannabinol (THC). Dieses Cannabinoid - synthetisch unter dem Gattungsnamen Dronabinol - ist in den Vereinigten Staaten, Kanada und einigen europäischen Ländern zur medizinischen Verwendung zugelassen. Da seine Vorteile gegenüber anderen Antiemetika und Schmerzmitteln fraglich sind, wird Dronabinol nur bei Unverträglichkeiten gegenüber der Standardtherapie verschrieben.
Im Jahr 2015 haben Forscher der Universität Yale (USA) unter der Leitung von Tamas Horvath die Paradoxie dieser Mechanismen aufgedeckt: Der Appetit wird durch die Aktivierung von Hirnschaltkreisen geweckt, deren normale Funktion darin besteht, das Gefühl der Sättigung zu erzeugen, aber keineswegs unkontrollierten Hunger. Das Paradoxon stellte sich jedoch nur als äußerlich heraus: Eine Studie, die an einer speziellen Linie genetisch veränderter Mäuse durchgeführt wurde, brachte Licht ins Dunkel des "Hackens" des Sättigungsgefühls. Es wurde durch eine komplexe Funktionsweise einer speziellen Gruppe von Hypothalamus-Neuronen erklärt, die Proopiomelanocortin produzieren, einen Vorläufer einer Reihe von Hormonen, darunter adrenocorticotropes Hormon, Melanozyten-stimulierende Hormone und das endogene Opioid β-Endorphin.
Im Jahr 2015 haben Forscher der Universität Yale (USA) unter der Leitung von Tamas Horvath die Paradoxie dieser Mechanismen aufgedeckt: Der Appetit wird durch die Aktivierung von Hirnschaltkreisen geweckt, deren normale Funktion darin besteht, das Gefühl der Sättigung zu erzeugen, aber keineswegs unkontrollierten Hunger. Das Paradoxon stellte sich jedoch nur als äußerlich heraus: Eine Studie, die an einer speziellen Linie genetisch veränderter Mäuse durchgeführt wurde, brachte Licht ins Dunkel des "Hackens" des Sättigungsgefühls. Es wurde durch eine komplexe Funktionsweise einer speziellen Gruppe von Hypothalamus-Neuronen erklärt, die Proopiomelanocortin produzieren, einen Vorläufer einer Reihe von Hormonen, darunter adrenocorticotropes Hormon, Melanozyten-stimulierende Hormone und das endogene Opioid β-Endorphin.
Das zentrale Bindeglied bei der Appetitregulierung
Die zentrale Appetitregulierung erfolgt über die Signalwege im Hypothalamus, vor allem im Nucleus arcuatus. Da die Blut-Hirn-Schranke lokal nicht vorhanden ist, integriert der Hypothalamus hormonelle Signale aus dem Verdauungssystem, dem Fettgewebe und dem Belohnungssystem des Gehirns und erzeugt in Abhängigkeit davon "Befehle", die den Stoffwechsel, die Darmmotilität und den Appetit schwächen oder steigern. Die Zellen des Bogenkerns übertragen Signale an Neuronen der Ordnung II in anderen Teilen des Hypothalamus, insbesondere im paraventrikulären Kern, wo Hormone produziert werden, die die Aktivität des sympathischen Nervensystems sowie die Funktion der Schilddrüse und der Nebennieren regulieren.
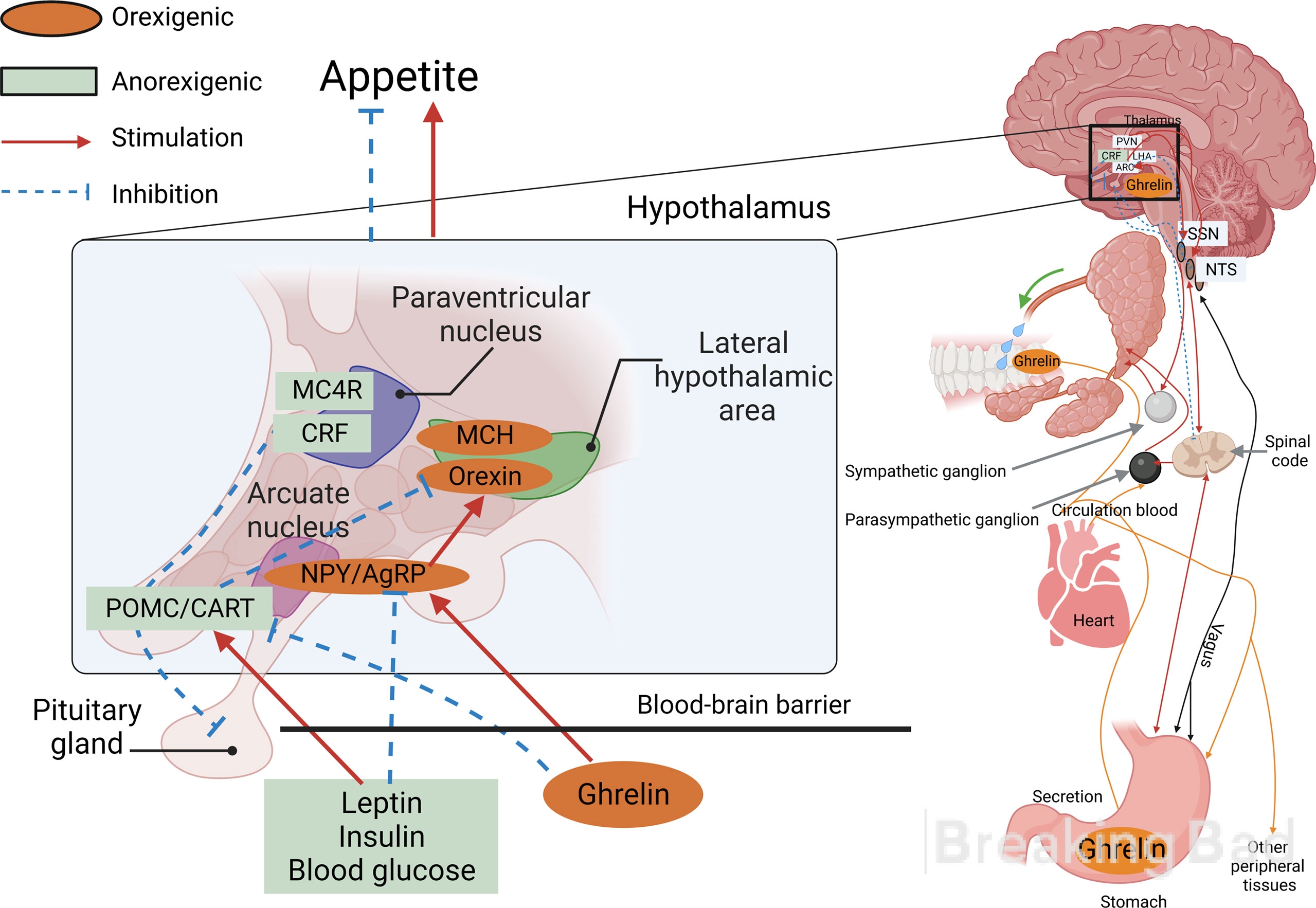
Innerhalb des bogenförmigen Kerns des Hypothalamus gibt es zwei Populationen von Neuronen, die in unterschiedliche Richtungen wirken und so das Energiegleichgewicht des Körpers aufrechterhalten (die Abbildung zeigt den molekularen Mechanismus der Aufrechterhaltung dieses Gleichgewichts und der Appetitregulierung).
Die Abbildung zeigt den molekularen Mechanismus der Aufrechterhaltung dieses Gleichgewichts und der Appetitregulierung. Im bogenförmigen Kern des Hypothalamus gibt es zwei Populationen von Neuronen, die in unterschiedliche Richtungen wirken und so das Energiegleichgewicht des Körpers aufrechterhalten .
Die zentrale Appetitregulierung erfolgt über die Signalwege im Hypothalamus, vor allem im Nucleus arcuatus. Da die Blut-Hirn-Schranke lokal nicht vorhanden ist, integriert der Hypothalamus hormonelle Signale aus dem Verdauungssystem, dem Fettgewebe und dem Belohnungssystem des Gehirns und erzeugt in Abhängigkeit davon "Befehle", die den Stoffwechsel, die Darmmotilität und den Appetit schwächen oder steigern. Die Zellen des Bogenkerns übertragen Signale an Neuronen der Ordnung II in anderen Teilen des Hypothalamus, insbesondere im paraventrikulären Kern, wo Hormone produziert werden, die die Aktivität des sympathischen Nervensystems sowie die Funktion der Schilddrüse und der Nebennieren regulieren.
Innerhalb des bogenförmigen Kerns des Hypothalamus gibt es zwei Populationen von Neuronen, die in unterschiedliche Richtungen wirken und so das Energiegleichgewicht des Körpers aufrechterhalten (die Abbildung zeigt den molekularen Mechanismus der Aufrechterhaltung dieses Gleichgewichts und der Appetitregulierung).
Die Abbildung zeigt den molekularen Mechanismus der Aufrechterhaltung dieses Gleichgewichts und der Appetitregulierung. Im bogenförmigen Kern des Hypothalamus gibt es zwei Populationen von Neuronen, die in unterschiedliche Richtungen wirken und so das Energiegleichgewicht des Körpers aufrechterhalten .
- Neuronen, die orexigene Peptide produzieren, die den Appetit anregen und die Stoffwechselrate und den Energieverbrauch senken, sind das agoutiähnliche Protein und das Neuropeptid Y (das vorherrschende Peptid des ZNS).
- Neuronen, die anorexigene, appetithemmende Neuropeptide produzieren, sind Proopiomelanocortin und das kokain-amphetamin-regulierte Transkript. Über das kokain-amphetamin-regulierte Transkript ist noch wenig bekannt. Es scheint ein endogenes Psychostimulans zu sein, das eine ähnliche Wirkung wie Amphetamin und Kokain hat und ein potenzielles Ziel für die Suchttherapie darstellt. Mutationen des CARTPT-Gens wurden mit einer Neigung zum Alkoholismus in Verbindung gebracht. Es wird angenommen, dass CARTPT eine Schlüsselrolle bei der Modulation der Aktivität des mesolimbischen Dopaminwegs des Belohnungssystems im Gehirn spielt. Es hat sich gezeigt, dass dieses Peptid den Appetit und die Fettansammlung reduziert, und eine Abnahme seiner Aktivität im Hypothalamus von Tieren (z. B. bei Depressionen) führt zu Völlerei und Fettleibigkeit.
Peripheres Bindeglied bei der Appetitregulierung
Man geht davon aus, dass die wichtigsten peripheren Modulatoren des Essverhaltens die Hormone Insulin, Leptin und Ghrelin sind, die einen unterschiedlich gerichteten Einfluss auf die Aktivität der hypothalamischen Neuronen haben.
Leptin - wird von den Zellen des Fettgewebes bei der Nahrungsaufnahme im Verhältnis zur Fettmenge im Körper ausgeschüttet und reduziert den Appetit.
Insulin - wird von den β-Zellen der Langerhansschen Inseln der Bauchspeicheldrüse nach einer Mahlzeit ausgeschüttet. Die periphere Wirkung des Insulins ist anabol und antikatabol: es steigert die Synthese von Fetten und Proteinen, erhöht den Eintritt von Glukose in die Zellen (und senkt ihren Spiegel im Blut), stimuliert die Bildung von Glykogen aus Glukose und hemmt den Abbau von Glykogen und Fetten. Die zentrale Wirkung von Insulin hingegen ist katabolisch - es reduziert den Appetit und verschiebt die Energiebilanz auf die "Ausgabenseite".
Sowohl Leptin als auch Insulin interagieren mit beiden neuronalen Populationen: Sie hemmen die ourexigenen NP-y/APB-Zellen und aktivieren die bedingt anorexigenen POMC/CART-Zellen (siehe Abbildung mit Moleküldiagramm). Leptin reduziert außerdem die Ausschüttung des hemmenden Mediators GABA aus Axonen, die mit POMC-Neuronen in Kontakt stehen. All dies führt in der Regel zu einer anorexigenen Wirkung, d. h. zu einer Unterdrückung des Appetits.
Die Zellen des Magen-Darm-Trakts synthetisieren eine Reihe von magersüchtigen Hormonen und nur ein appetitanregendes Peptid, Ghrelin (Hungerhormon). Es wird von den Wänden des Magens und des Dünndarms während des Hungers produziert und interagiert im Gehirn mit den Wachstumshormonrezeptoren (GHSR1a) und stimuliert dessen Sekretion, wofür es den Namen Wachstumshormonfreisetzungsinduktor (Ghrelin) erhielt. Im Nucleus arcuatus des Hypothalamus erregt Ghrelin die NP-y/APB-Neuronen, was den Menschen zum Essen anregt, und vermittelt auch den Genuss von Alkohol und köstlichen Speisen.
Cannabinoid-Anwendungspunkte in diesem Schema
Wie wir herausgefunden haben, ist die Folge der Stimulation der POMC-Neuronen eine Abnahme des Appetits, und die der APB-Neuronen eine Zunahme des Appetits. Daher wäre es logisch, das Phänomen des "Heißhungers" nach Marihuanakonsum durch die Hemmung der ersten Zellpopulation und/oder die Aktivierung der zweiten zu erklären. Eine kürzlich von der Gruppe von Tamas Horvath durchgeführte Studie ergab jedoch, dass Cannabis in Wirklichkeit genau das Gegenteil bewirkt: Hunger wird bei wohlgenährten Menschen durch die Aktivierung von POMC-Neuronen ausgelöst, während die APB-Zellen "schweigen".
Auf der Grundlage der gesammelten Beweise schlugen die Autoren der Arbeit ein Schema der Erregung von POMC-Neuronen durch Cannabinoide vor, das zwei Wege umfasst.
Man geht davon aus, dass die wichtigsten peripheren Modulatoren des Essverhaltens die Hormone Insulin, Leptin und Ghrelin sind, die einen unterschiedlich gerichteten Einfluss auf die Aktivität der hypothalamischen Neuronen haben.
Leptin - wird von den Zellen des Fettgewebes bei der Nahrungsaufnahme im Verhältnis zur Fettmenge im Körper ausgeschüttet und reduziert den Appetit.
Insulin - wird von den β-Zellen der Langerhansschen Inseln der Bauchspeicheldrüse nach einer Mahlzeit ausgeschüttet. Die periphere Wirkung des Insulins ist anabol und antikatabol: es steigert die Synthese von Fetten und Proteinen, erhöht den Eintritt von Glukose in die Zellen (und senkt ihren Spiegel im Blut), stimuliert die Bildung von Glykogen aus Glukose und hemmt den Abbau von Glykogen und Fetten. Die zentrale Wirkung von Insulin hingegen ist katabolisch - es reduziert den Appetit und verschiebt die Energiebilanz auf die "Ausgabenseite".
Sowohl Leptin als auch Insulin interagieren mit beiden neuronalen Populationen: Sie hemmen die ourexigenen NP-y/APB-Zellen und aktivieren die bedingt anorexigenen POMC/CART-Zellen (siehe Abbildung mit Moleküldiagramm). Leptin reduziert außerdem die Ausschüttung des hemmenden Mediators GABA aus Axonen, die mit POMC-Neuronen in Kontakt stehen. All dies führt in der Regel zu einer anorexigenen Wirkung, d. h. zu einer Unterdrückung des Appetits.
Die Zellen des Magen-Darm-Trakts synthetisieren eine Reihe von magersüchtigen Hormonen und nur ein appetitanregendes Peptid, Ghrelin (Hungerhormon). Es wird von den Wänden des Magens und des Dünndarms während des Hungers produziert und interagiert im Gehirn mit den Wachstumshormonrezeptoren (GHSR1a) und stimuliert dessen Sekretion, wofür es den Namen Wachstumshormonfreisetzungsinduktor (Ghrelin) erhielt. Im Nucleus arcuatus des Hypothalamus erregt Ghrelin die NP-y/APB-Neuronen, was den Menschen zum Essen anregt, und vermittelt auch den Genuss von Alkohol und köstlichen Speisen.
Cannabinoid-Anwendungspunkte in diesem Schema
Wie wir herausgefunden haben, ist die Folge der Stimulation der POMC-Neuronen eine Abnahme des Appetits, und die der APB-Neuronen eine Zunahme des Appetits. Daher wäre es logisch, das Phänomen des "Heißhungers" nach Marihuanakonsum durch die Hemmung der ersten Zellpopulation und/oder die Aktivierung der zweiten zu erklären. Eine kürzlich von der Gruppe von Tamas Horvath durchgeführte Studie ergab jedoch, dass Cannabis in Wirklichkeit genau das Gegenteil bewirkt: Hunger wird bei wohlgenährten Menschen durch die Aktivierung von POMC-Neuronen ausgelöst, während die APB-Zellen "schweigen".
Auf der Grundlage der gesammelten Beweise schlugen die Autoren der Arbeit ein Schema der Erregung von POMC-Neuronen durch Cannabinoide vor, das zwei Wege umfasst.
- Der präsynaptische Weg: Wenn Cannabinoide mit CB1R-Rezeptoren von Axonen interagieren, die Synapsen mit POMC-Neuronen bilden, wird die Freisetzung des hemmenden Neurotransmitters GABA aus präsynaptischen Neuronen (z. B. APB-Zellen) blockiert. Infolgedessenkönnen die POMC-Neuronen erregt werden.
- Mitochondrialer Weg (neu und grundlegend): Wenn Cannabinoide mit den CB1R-Rezeptoren der mitochondrialen POMC-Neuronen interagieren, wird die mitochondriale Atmung stimuliert, reaktive Sauerstoffspezies (ROS) werden produziert und die Expression des mitochondrialen Entkopplungsproteins 2 (RB2, UCP2) erhöht. Dieses Protein ist an der Regulierung der AFC-Produktion und des Essverhaltens beteiligt.
Aber warum schütten die Zellen in diesem Fall β-Endorphin aus? Tatsache ist, dass das entgegengesetzt wirkende α-MSH und das β-Endorphin von demselben Pomc-Gen kodiert werden, da sie durch posttranslationale Umwandlungen aus demselben POMC-Peptid gebildet werden. Die Genexpressionsniveaus der beiden Konvertasen, die diese Bildung vornehmen, unterscheiden sich nicht, wenn Cannabinoide an CB1R-Rezeptoren binden.
Offenbar werden auch in diesem Fall α-MSH und β-Endorphin in gleicher Menge produziert, aber selektiv von POMC-Neuronen ausgeschüttet. Tamas Horvath und seine Kollegen zeigten, dass etwa 35 % der neuronalen Knospen des POMC, die Synapsen mit Neuronen des paraventrikulären Kerns bilden, sekretorische Bläschen mit entweder α-MSH oder β-Endorphin enthalten. Das heißt, diese Peptide werden synchron und in gleichen Mengen produziert, aber getrennt gespeichert und vor allem von POMC-Neuronen unter der Kontrolle verschiedener Signale sezerniert. RB2 schaltet unter dem Einfluss von Cannabinoiden "den Pfeil" vom Weg der Sekretion von appetitminderndem α-MSH auf den Weg der Sekretion von β-Endorphin um, was zu unwiderstehlichem Heißhunger (und möglicherweise zu Fettleibigkeit) führt.
Es ist noch nicht bekannt, ob die beschriebene Wirkung von PB2 nur bei der POMC-Neuronenpopulation auftritt, denn es wurde bereits gezeigt, dass dieses Protein auch von vielen anderen Zellen im Nervensystem produziert wird. Es ist auch nicht bekannt, ob Neuronen in anderen Hirnregionen auf Cannabinoide in genau der gleichen Weise reagieren. Das Yale-Team konzentrierte sich speziell auf das CB1R-vermittelte unkontrollierte Essen von gesättigten Tieren, was genau das ist, was Cannabinoid-Liebhaber tun. Es ist möglich, dass hypothalamische POMC-Neuronen auch an der Entwicklung anderer Symptome beteiligt sind, die mit Marihuana-Konsum in Verbindung gebracht werden.

Schlussfolgerung
So werden paradoxerweise die Neuronen, die normalerweise ein Sättigungsgefühl auslösen, unter dem Einfluss von THC zur treibenden Kraft hinter der Nahrungsaufnahme. Cannabis aktiviert den Riechkolben im Gehirn (die Abteilung, die für das Erkennen von Gerüchen zuständig ist), was dazu führt, dass Lebensmittel besser und stärker riechen. THC wirkt auch auf Rezeptoren in einem Bereich des Gehirns, dem so genannten Nucleus adjoiningus, der die Freisetzung des Neurotransmitters Dopamin erhöht. Die Freisetzung von Dopamin steigert das Gefühl der Freude am Essen. Das Gehirn schüttet von Natur aus Dopamin aus, wenn wir angenehme Lebensmittel essen, aber wenn THC vorhanden ist, erhält der Körper eine zusätzliche Dopaminausschüttung durch das, was Sie essen.
THC interagiert auch mit CB1-Rezeptoren im Hypothalamus, um ein Hormon namens Ghrelin freizusetzen, ein appetitanregendes Hormon, das die Verdauung beschleunigt. THC stimuliert nicht nur dieses Hormon, sondern Ghrelin ist auch für die Entstehung von Hungergefühlen verantwortlich, die eine Rolle im Kohlenhydratstoffwechsel spielen, weshalb Wissenschaftler vermuten, dass THC Hungergefühle und ein Verlangen nach kohlenhydratreichen Substanzen auslöst.
Offenbar werden auch in diesem Fall α-MSH und β-Endorphin in gleicher Menge produziert, aber selektiv von POMC-Neuronen ausgeschüttet. Tamas Horvath und seine Kollegen zeigten, dass etwa 35 % der neuronalen Knospen des POMC, die Synapsen mit Neuronen des paraventrikulären Kerns bilden, sekretorische Bläschen mit entweder α-MSH oder β-Endorphin enthalten. Das heißt, diese Peptide werden synchron und in gleichen Mengen produziert, aber getrennt gespeichert und vor allem von POMC-Neuronen unter der Kontrolle verschiedener Signale sezerniert. RB2 schaltet unter dem Einfluss von Cannabinoiden "den Pfeil" vom Weg der Sekretion von appetitminderndem α-MSH auf den Weg der Sekretion von β-Endorphin um, was zu unwiderstehlichem Heißhunger (und möglicherweise zu Fettleibigkeit) führt.
Es ist noch nicht bekannt, ob die beschriebene Wirkung von PB2 nur bei der POMC-Neuronenpopulation auftritt, denn es wurde bereits gezeigt, dass dieses Protein auch von vielen anderen Zellen im Nervensystem produziert wird. Es ist auch nicht bekannt, ob Neuronen in anderen Hirnregionen auf Cannabinoide in genau der gleichen Weise reagieren. Das Yale-Team konzentrierte sich speziell auf das CB1R-vermittelte unkontrollierte Essen von gesättigten Tieren, was genau das ist, was Cannabinoid-Liebhaber tun. Es ist möglich, dass hypothalamische POMC-Neuronen auch an der Entwicklung anderer Symptome beteiligt sind, die mit Marihuana-Konsum in Verbindung gebracht werden.
Schlussfolgerung
So werden paradoxerweise die Neuronen, die normalerweise ein Sättigungsgefühl auslösen, unter dem Einfluss von THC zur treibenden Kraft hinter der Nahrungsaufnahme. Cannabis aktiviert den Riechkolben im Gehirn (die Abteilung, die für das Erkennen von Gerüchen zuständig ist), was dazu führt, dass Lebensmittel besser und stärker riechen. THC wirkt auch auf Rezeptoren in einem Bereich des Gehirns, dem so genannten Nucleus adjoiningus, der die Freisetzung des Neurotransmitters Dopamin erhöht. Die Freisetzung von Dopamin steigert das Gefühl der Freude am Essen. Das Gehirn schüttet von Natur aus Dopamin aus, wenn wir angenehme Lebensmittel essen, aber wenn THC vorhanden ist, erhält der Körper eine zusätzliche Dopaminausschüttung durch das, was Sie essen.
THC interagiert auch mit CB1-Rezeptoren im Hypothalamus, um ein Hormon namens Ghrelin freizusetzen, ein appetitanregendes Hormon, das die Verdauung beschleunigt. THC stimuliert nicht nur dieses Hormon, sondern Ghrelin ist auch für die Entstehung von Hungergefühlen verantwortlich, die eine Rolle im Kohlenhydratstoffwechsel spielen, weshalb Wissenschaftler vermuten, dass THC Hungergefühle und ein Verlangen nach kohlenhydratreichen Substanzen auslöst.
