G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,730
- Solutions
- 3
- Reaction score
- 2,899
- Points
- 113
- Deals
- 1
Reacciones con reactivos de Grignard.
Un reactivo de Grignard tiene una fórmula RMgX donde X es un halógeno y R es un grupo alquilo o arilo (basado en un anillo de benceno). Para los fines de este tema, tomaremos R como un grupo alquilo (por ejemplo, BuMgBr). Los reactivos de Grignard se fabrican añadiendo el halogenoalcano a pequeños trozos de magnesio en un matraz que contiene éter dietílico. El matraz se equipacon un condensador de reflujo y la mezcla se calienta en un baño de agua durante 20-30 minutos.
Todo debe estar perfectamente seco porque los reactivos de Grignard reaccionan con el agua (véase más adelante). Cualquier reacción en la que se utilice el reactivo de Grignard se lleva a cabo con la mezcla resultante de esta reacción. No sepuede separar de ninguna manera.
Reactivos de Grignardy agua.
Los reactivos de Grignard reaccionan con el agua para producir alcanos. Esta es la razón por la que todo tiene que estar muy seco durante la preparación anterior. Por ejemplo:El producto inorgánico, Mg(OH)Br, se denomina "bromuro básico" y es una especie de etapa intermedia entre el bromuro de magnesio y el hidróxido de magnesio.
Reacción general entre Grignards y carbonilos.
Las reacciones entre los distintos tipos de compuestos carbonílicos y los reactivos de Grignard pueden parecer bastante complicadas, pero en realidad todos reaccionan de la misma manera: lo único que cambia son los grupos unidos al doble enlace carbono-oxígeno. Es mucho más fácil entender lo que ocurre si se examina detenidamente el caso general (utilizando grupos "R" en lugar de grupos específicos) y luego se introducen los distintos grupos reales cuando sea necesario.
Las reacciones son esencialmente idénticas a la reacción con dióxido de carbono; lo único que difiere es la naturaleza del producto orgánico. En la primera etapa, el reactivo de Grignard se añade a través del doble enlace carbono-oxígeno.
Las reacciones son esencialmente idénticas a la reacción con dióxido de carbono; lo único que difiere es la naturaleza del producto orgánico. En la primera etapa, el reactivo de Grignard se añade a través del doble enlace carbono-oxígeno.
A continuación, se añade ácido diluido para hidrolizarlo. (Estoy utilizando la ecuación normalmente aceptada, ignorando el hecho de que el Mg(OH)Br reaccionará aún más con el ácido).
Se forma un alcohol. Uno de los usos clave de los reactivos de Grignard es la capacidad de producir alcoholes complicados con facilidad. El tipo de alcohol que se obtenga dependerá del compuesto carbonílico con el que se haya empezado, es decir, de lo que sean R y R'.
Los reactivos de Grignard se utilizan ampliamente para la síntesis de diversas clases de compuestos orgánicos. A continuación se presentan algunos ejemplos.
Reacciones con:
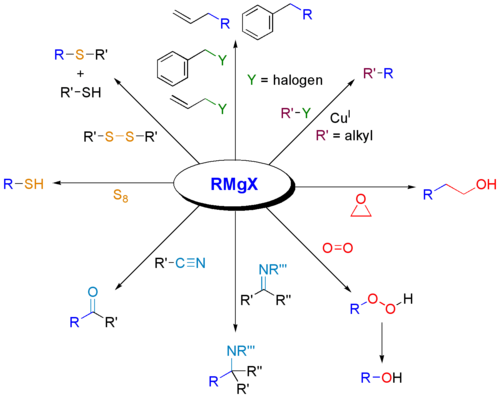
¿Por qué los reactivos de Grignard reaccionan con carbonilos?
El enlace entre el átomo de carbono y el magnesio es polar. El carbono es más electronegativo que el magnesio, por lo que el par de electrones del enlace es atraído hacia el carbono. Esto deja al átomo de carbono con una ligera carga negativa.
El doble enlace carbono-oxígeno también es muy polar, con una cantidad significativa de carga positiva en el átomo de carbono. Por tanto, el reactivo de Grignard puede servir como nucleófilo debido a la atracción entre la ligera negatividad del átomo de carbono en el reactivo de Grignard y la positividad del carbono en el compuesto carbonílico. Un nucleófilo es un átomo negativo (o ligeramente negativo) que ataca centros positivos (o ligeramente positivos) en otras moléculas o iones.
Preparación del reactivo de Grignard, bromuro de fenilmagnesio.
Los reactivos de Grignard desempeñan un papel preponderante en la síntesis orgánica. Estos compuestos pueden adaptarse a la preparación de una gran variedad de grupos funcionales, y la formación y reacción de derivados organomagnésicos es uno de los principales usos de los haluros de alquilo en síntesis orgánica. La reacción de un haluro y el magnesio se produce en la superficie del metal y es formalmente una oxidación del metal. La reacción suele llevarse a cabo en disolvente éter seco, que actúa como base de Lewis al disolver el reactivo de Grignard y permitir su difusión lejos del metal. La formación del reactivo organometálico requiere una superficie activa en el metal, y puede haber algunas dificultades para iniciar la reacción debido a la presencia de óxidos metálicos en la superficie del metal. Moler el magnesio en un mortero durante unos minutos antes de utilizarlo suele ser eficaz para obtener una superficie limpia. Otro truco útil para iniciar una reacción es la adición de un pequeño cristal de yodo a la mezcla, que reacciona con el magnesio para formar la muy reactiva sal de yoduro de magnesio (MgI2).
Procedimiento.
El reactivo de Grignard se prepara adaptando primero un matraz seco de fondo redondo de 250 ml con un tubo de secado de CaCl2. Se coloca en el matraz el magnesio que se va a utilizar (2 g = 0,082 moles de magnesio torneado), se acopla directamente el tubo de cloruro cálcico y se calienta a fondo el matraz con una gran manta calefactora y un reóstato. Ajustar el regulador de una gran manta calefactora en la posición "6" y calentar el matraz hasta que esté demasiado caliente para tocarlo con el dedo. Al enfriarse, el matraz hace pasar aire seco a través del cloruro de calcio. Retire el manto calefactor y enfríe a temperatura ambiente (el matraz debe estar ligeramente caliente en la mano, o más frío) antes de continuar. Retire el tubo de secado de cloruro cálcico y vierta en el matraz de fondo redondo de 250 15 ml de éter absoluto y 9 ml (13,5 g = 0,086 moles) de bromobenceno. Volver a colocar el tubo de secado de CaCl2. Si no hay signos inmediatos de reacción, iniciar la reacción triturando algunas de las virutas de magnesio. Esto se hace introduciendo una varilla agitadora seca con el extremo aplanado y aplastando con cuidado un trozo de magnesio firmemente contra el fondo del matraz, bajo la superficie del líquido, dando un movimiento giratorio a la varilla. Cuando esto se hace correctamente, el líquido se enturbia ligeramente y comienza un rápido burbujeo en la superficie del metal comprimido. Eneste punto, añada 25 ml más de éter absoluto y fije un refrigerante de reflujo al matraz y el tubo de CaCl2 a la parte superior del refrigerante de reflujo, como se muestra en la figura.
No empieces a hacer pasar agua por el condensador hasta que los vapores de éter hayan mojado la junta de la parte superior del condensador. Cuando sea necesario, enfría el matraz tocando el fondo del matraz con un baño de hielo para ralentizar la reacción, pero no lo utilices a menos que sea necesario. Sólo es necesario si los vapores de éter salen por la parte superior del tubo de secado. Si tienes que enfriar la reacción, ten cuidado de no ralentizarla demasiado, o podría detenerse y no volver a empezar cuando se retire el hielo. Agita enérgicamente el matraz cada sesenta segundos. Una vez iniciada la reacción, la ebullición espontánea en la mezcla diluida puede ser lenta o volverse lenta. Si es así, añada unos ml adicionales de bromobenceno al matraz. La reacción estará completa cuando el éter deje de burbujear y sólo queden unos pequeños restos de metal. Marca el nivel de éter en el matraz. Durante la reacción, comprueba que el volumen de éter no ha disminuido. Si es así, añade más éter seco. Dado que la solución delreactivo de Grignard se deteriora al reposar, debe iniciarse inmediatamente el siguiente paso.
Condensación del reactivo de Grignard con benzoato de metilo.
Condensación del reactivo de Grignard con benzoato de metilo.
Mezclar 5 g (0,037 mol; 1,09 g/ml) de benzoato de metilo y 15 ml de éter absoluto en un embudo de decantación, enfriar brevemente el matraz que contiene la solución del reactivo de Grignard en un baño de hielo. Retire el tubo de secado e inserte un adaptador de Claisen y un embudo de decantación en la parte superior del condensador, como se muestra a la derecha. Introduzca la solución de benzoato de metilo gota a gota durante diez minutos, enfriando sólo lo necesario para controlar la reacción exotérmica. La sal del producto se separa como un sólido blanco durante este paso. Agitar el matraz a intervalos regulares hasta que la reacción haya disminuido y el matraz esté a temperatura ambiente. Vaya directamente al paso siguiente.
Hidrólisis del producto de adición.
Hidrólisis del producto de adición.
Vierta cuidadosamente la mezcla de reacción en un matraz Erlenmeyer de 250 ml que contenga 50 ml de ácido sulfúrico al 10% y unos 25 g de hielo. Utilice unos ml de éter ordinario (no anhidro) y unos ml de ácido sulfúrico al 10% para enjuagar el matraz de reacción. Añadir estos lavados al matraz Erlenmeyer. Agitar bien para promover la hidrólisis del compuesto de adición; las sales básicas de magnesio se convierten en sales neutras solubles en agua, y el trifenilcarbinol se distribuye en la capa de éter. Puede ser necesaria una cantidad adicional de éter (ordinario) si la capa de éter original se ha reducido demasiado por evaporación. Puede detenerse en este punto si no hay tiempo suficiente para completar la siguiente parte. Guarda el erlenmeyer etiquetado en la campana con un tapón de corcho (no de goma) ligeramente ajustado. El tapón debe estar lo suficientemente flojo como para que se libere la presión del gas de hidrógeno en evolución.
Cuando el Mg metálico no consumido entre en contacto con el ácido, se producirá una vigorosa evolución de gas de hidrógeno y la mezcla de reacción puede formar espuma si la adición es demasiado rápida.
Aislamiento del producto.
Si su capa de éter tiene cristales blancos sólidos, estos cristales de producto se han formado porque se ha evaporado parte de la capa de éter. Estos cristales pueden aislarse vertiendo la mezcla en un embudo de decantación a través de un embudo de vidrio con un pequeño tapón de lana de vidrio en el vástago. Enjuagar los cristales con una pequeña cantidad de disolvente de éter. Para aislar el producto restante, enjuague el matraz Erlenmeyer, del que vertió la solución original, con unos pocos mL de éter ordinario y añádalo al embudo de decantación. Agita el embudo, asegurándote cuidadosamente de ventilar la acumulación de gas en el embudo. Eliminar la capa acuosa. Agitar la capa de éter con ácido sulfúrico al 10% para seguir eliminando las sales de magnesio y retirar la capa de ácido sulfúrico. Lavar la capa de éter con solución saturada de cloruro sódico para eliminar el agua disuelta en el éter. Eliminar la solución de cloruro sódico. Las cantidades de líquido utilizadas en estas operaciones de lavado no son críticas. En general, una cantidad de líquido de lavado igual a un tercio del volumen de éter es adecuada. Para efectuar el secado final de la solución de éter, verter la capa de éter por el cuello del embudo de decantación en un matraz Erlenmeyer, añadir unos 5 g de sulfato sódico anhidro granular, agitar el matraz de vez en cuando y, transcurridos 5 minutos, decantar el éter del agente de secado sólido en otro matraz Erlenmeyer limpio y seco. Añadir 25 ml de ligroína a la solución etérea y tapar el matraz con un tapón de corcho. Deje reposar la mezcla durante toda la noche o hasta el siguiente período de laboratorio. Tras el reposo, deben haberse formado cristales de trifenilcarbinol. La impureza principal bifenilo debe permanecer soluble en el disolvente de recristalización. Filtre los cristales por succión hasta que se sequen. Registrar el peso del producto aislado y calcular el % de rendimiento. Tomarel punto de fusión.
Cuando el Mg metálico no consumido entre en contacto con el ácido, se producirá una vigorosa evolución de gas de hidrógeno y la mezcla de reacción puede formar espuma si la adición es demasiado rápida.
Aislamiento del producto.
Si su capa de éter tiene cristales blancos sólidos, estos cristales de producto se han formado porque se ha evaporado parte de la capa de éter. Estos cristales pueden aislarse vertiendo la mezcla en un embudo de decantación a través de un embudo de vidrio con un pequeño tapón de lana de vidrio en el vástago. Enjuagar los cristales con una pequeña cantidad de disolvente de éter. Para aislar el producto restante, enjuague el matraz Erlenmeyer, del que vertió la solución original, con unos pocos mL de éter ordinario y añádalo al embudo de decantación. Agita el embudo, asegurándote cuidadosamente de ventilar la acumulación de gas en el embudo. Eliminar la capa acuosa. Agitar la capa de éter con ácido sulfúrico al 10% para seguir eliminando las sales de magnesio y retirar la capa de ácido sulfúrico. Lavar la capa de éter con solución saturada de cloruro sódico para eliminar el agua disuelta en el éter. Eliminar la solución de cloruro sódico. Las cantidades de líquido utilizadas en estas operaciones de lavado no son críticas. En general, una cantidad de líquido de lavado igual a un tercio del volumen de éter es adecuada. Para efectuar el secado final de la solución de éter, verter la capa de éter por el cuello del embudo de decantación en un matraz Erlenmeyer, añadir unos 5 g de sulfato sódico anhidro granular, agitar el matraz de vez en cuando y, transcurridos 5 minutos, decantar el éter del agente de secado sólido en otro matraz Erlenmeyer limpio y seco. Añadir 25 ml de ligroína a la solución etérea y tapar el matraz con un tapón de corcho. Deje reposar la mezcla durante toda la noche o hasta el siguiente período de laboratorio. Tras el reposo, deben haberse formado cristales de trifenilcarbinol. La impureza principal bifenilo debe permanecer soluble en el disolvente de recristalización. Filtre los cristales por succión hasta que se sequen. Registrar el peso del producto aislado y calcular el % de rendimiento. Tomarel punto de fusión.
Síntesis de sustancias psicoactivas con reactivo de Grignard.
El reactivo de Grignard se utiliza en la síntesis de varios tensioactivos. Por ejemplo, en la síntesis de cannabinoides sintéticos para la unión de un grupo alquilo al átomo de nitrógeno del indol (véase el ejemplo de síntesis de JWH-018 ). La reacción se produce con bastante rapidez en condiciones suaves y no requiere calentamiento.
La adición nucleofílica del reactivo de Grignard permite cierta reacción inespecífica y estereoespecífica para producir anfetamina y su precursor, como la fenil-2-propanona (P2P).
Otro método de aplicación del reactivo de Grignard es su uso en la síntesis dela ruta a la mefedrona (4-MMC) utilizando 4-metilbenzaldehído como material de partida.
La reacción de yoduro de indolilmagnesio con halogenuros de alquilo sustituidos, por ejemplo, los nitrilos Cl(CH2)nCN y cloroacetildietilamida, para dar los correspondientes indoles 3-sustituidos está bien reconocida aunque halogenuros muy reactivos, como yoduro de metilo y cloruro de bencilo, a veces dan indoles 1,3-disustituidos. Esta ruta DMT esposible con ayuda del reactivo de Grignard.
Ademásde la anterior variedad de aplicaciones, este popular enfoque se utiliza en la etapa de síntesis de la ketamina en la fabricación de (o-clorofenil)-ciclopentilo cetona.
Conclusión.
Como puede verse, el reactivo de Grignard se utiliza ampliamente en síntesis orgánicas y en la fabricación de fármacos en parte. Los halogenuros de alquilo y magnesio (también llamados reactivos de Grignard) actúan como nucleófilos, atacando un átomo de carbono electrófilo para formar un enlace carbono-carbono. La reacción de Grignard es un método importante para crear enlaces carbono-carbono, así como enlaces carbono-heteroátomo. Esta lista de las reacciones más populares entre los químicos clandestinos muestra el enorme potencial de las aplicaciones de los reactivos de Grignard y constituye un amplio campo de investigación.
Last edited:
