@G.Patton Creo que uno de los intermedios dibujados en esta síntesis (y del artículo original sobre el rodio) es incorrecto.
(3), la representación del intermediario anfetamina-formaldehído imina posee la misma estructura que la fenilacetona-metilamina imina que se puede ver en otro sitio
esto no me parece correcto por dos razones: en primer lugar, dibujar el mecanismo estándar para la formación de imina en el sustrato produce una imina en la que el doble enlace se encuentra entre N y el grupo metilo en la metanfetamina, y NO entre N y el carbono alfa como en la estructura de la lista. y pensar en ello: el doble enlace se genera cuando el par solitario de la amina se desprende del agua formada en el oxígeno del formaldehído como un grupo saliente, que debe hacerse en el lado del formaldehído (el grupo metilo en potencia)
en segundo lugar, se informa de que la síntesis es estereoespecífica en función del sustrato de partida. es decir, la reducción de d-amph producirá d-meth y lo mismo para el isómero l. la estructura tal y como se muestra (3) no posee centros quirales, y su reducción es equivalente a la aminación reductora estándar de la fenilacetona, que produce un producto racémico. la estructura propuesta que he dado para el intermediario posee un centro quiral, que sería el mismo que el del material de partida y, por tanto, coincidiría con la estereoespecificidad observada de la reacción.
si estoy en lo cierto, esto aclararía las cuestiones relativas a la estereoespecificidad de la reacción anteriormente en el hilo. si he cometido un error en alguna parte, pido disculpas, pero tenía curiosidad por saber por qué la reducción de la no quiral (3) conduce a una mezcla no racémica de productos cuando se utiliza un material de partida no racémico de anfetamina.
(3), la representación del intermediario anfetamina-formaldehído imina posee la misma estructura que la fenilacetona-metilamina imina que se puede ver en otro sitio
esto no me parece correcto por dos razones: en primer lugar, dibujar el mecanismo estándar para la formación de imina en el sustrato produce una imina en la que el doble enlace se encuentra entre N y el grupo metilo en la metanfetamina, y NO entre N y el carbono alfa como en la estructura de la lista. y pensar en ello: el doble enlace se genera cuando el par solitario de la amina se desprende del agua formada en el oxígeno del formaldehído como un grupo saliente, que debe hacerse en el lado del formaldehído (el grupo metilo en potencia)
en segundo lugar, se informa de que la síntesis es estereoespecífica en función del sustrato de partida. es decir, la reducción de d-amph producirá d-meth y lo mismo para el isómero l. la estructura tal y como se muestra (3) no posee centros quirales, y su reducción es equivalente a la aminación reductora estándar de la fenilacetona, que produce un producto racémico. la estructura propuesta que he dado para el intermediario posee un centro quiral, que sería el mismo que el del material de partida y, por tanto, coincidiría con la estereoespecificidad observada de la reacción.
si estoy en lo cierto, esto aclararía las cuestiones relativas a la estereoespecificidad de la reacción anteriormente en el hilo. si he cometido un error en alguna parte, pido disculpas, pero tenía curiosidad por saber por qué la reducción de la no quiral (3) conduce a una mezcla no racémica de productos cuando se utiliza un material de partida no racémico de anfetamina.
Hola. En primer lugar, el carbono a tiene más densidad electrónica que el carbono metilo. El mecanismo típico conduce a tal intermedio (oculto bajo la marca de agua de Breaking Bad, lo siento):
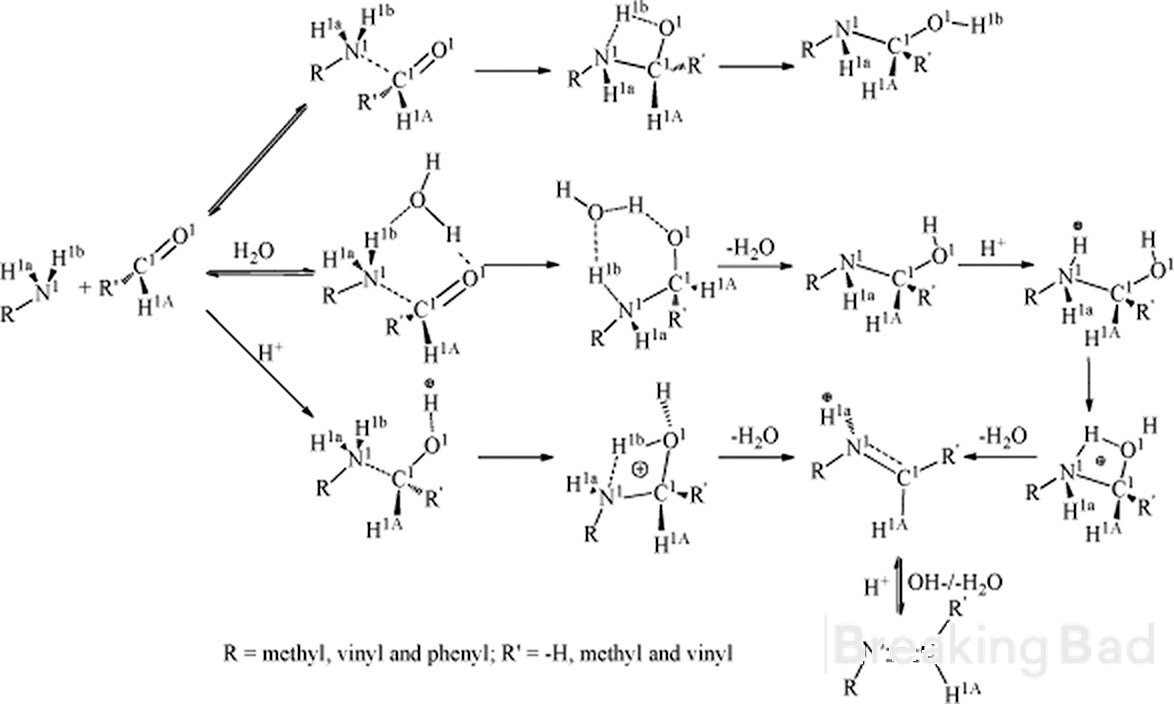
En segundo lugar, ¿tiene datos fiables sobre el resultado estereoespecífico de esta síntesis?
En segundo lugar, ¿tiene datos fiables sobre el resultado estereoespecífico de esta síntesis?
↑View previous replies…
- By NexusPrime
rodio es un error, el doble enlace no está ahí, véase el ejemplo con benzaldehído a continuación
