G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,730
- Solutions
- 3
- Reaction score
- 2,899
- Points
- 113
- Deals
- 1
Reaktsioonid Grignardi reaktiividega.
Grignardi reaktiivil on valem RMgX, kus X on halogeen ja R on alküül- või arüülrühm (põhineb benseeniringil). Käesolevas teemas võtame R-iks alküülrühma (nt BuMgBr). Grignardi reaktiivid valmistatakse halogeenalkaani lisamisel väikestele magneesiumitükkidele kolvis, mis sisaldab dietüüleetrit. Kolbile paigaldatakse tagasivoolukondensaator ja segu soojendatakse veevannil 20-30 minutit.
Kõik peab olema täiesti kuiv, sest Grignardi reaktiivid reageerivad veega (vt allpool). Kõik reaktsioonid, milles kasutatakse Grignardi reaktiivi, viiakse läbi sellest reaktsioonist saadud seguga. Seda ei saa kuidagi eraldada.
Grignardi reaktiivid ja vesi.
Grignardi reaktiivid reageerivad veega, et toota alkaane. See on põhjus, miks kõik peab eespool kirjeldatud valmistamise ajal olema väga kuiv. Näiteks:Anorgaanilist toodet Mg(OH)Br nimetatakse "aluseliseks bromiidiks" ja see on omamoodi pooleldi magneesiumbromiidi ja magneesiumhüdroksiidi vahel.
Üldine reaktsioon grignardide ja karbonüülide vahel.
Erinevate karbonüülühendite ja Grignardi reaktiivide vahelised reaktsioonid võivad tunduda üsna keerulised, kuid tegelikult reageerivad nad kõik ühtemoodi - muutuvad vaid süsinik-hapniku kaksiksidemega seotud rühmad. Palju lihtsam on aru saada, mis toimub, kui vaadelda üldjuhtumit (kasutades pigem "R"-rühmi kui konkreetseid rühmi) - ja seejärel lisada vastavalt vajadusele erinevad tegelikud rühmad.
Reaktsioonid on sisuliselt identsed süsinikdioksiidiga toimuva reaktsiooniga - erinev on vaid orgaanilise toote olemus. Esimeses etapis lisab Grignardi reaktiivi üle süsiniku ja hapniku kaksiksideme.
Reaktsioonid on sisuliselt identsed süsinikdioksiidiga toimuva reaktsiooniga - erinev on vaid orgaanilise toote olemus. Esimeses etapis lisab Grignardi reaktiivi üle süsiniku ja hapniku kaksiksideme.
Seejärel lisatakse sellele lahjendatud hape, et seda hüdrolüüsida. (Ma kasutan tavaliselt aktsepteeritud võrrandit, jättes tähelepanuta asjaolu, et Mg(OH)Br reageerib happega edasi).
Tekib alkohol. Grignardi reaktiivide üks peamisi kasutusalasid on võimalus valmistada keerulisi alkohole lihtsalt. See, millist alkoholi saadakse, sõltub sellest, millisest karbonüülühendist alustati - teisisõnu, millised on R ja R'.
Grignardi reaktiive kasutatakse laialdaselt erinevate orgaaniliste ühendite klasside sünteesiks. Allpool on esitatud mõned näited.
:
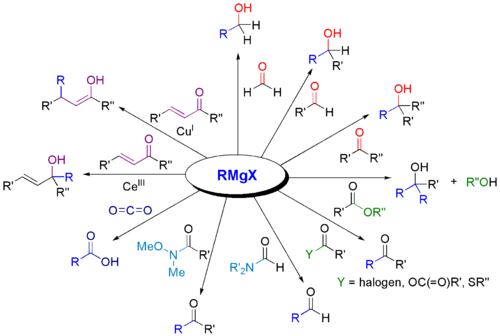
:
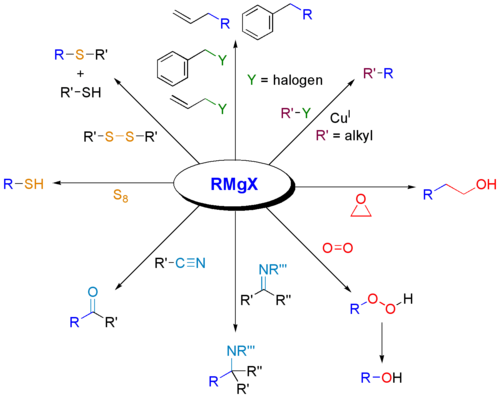
Miksreageerivad Grignardi reaktiivid karbonüülidega?
Süsiniku aatomi ja magneesiumi vaheline side on polaarne. Süsinik on elektronegatiivsem kui magneesium ja seega tõmmatakse sideme elektronpaar süsiniku poole. See jätab süsiniku aatomile kerge negatiivse laengu.
Süsiniku ja hapniku kaksikside on samuti väga polaarne, süsiniku aatomil on märkimisväärne hulk positiivset laengut. Grignardi reaktiiv võib seega toimida nukleofiilina, sest Grignardi reaktiivi süsiniku aatomi kergelt negatiivne ja karbonüülühendi süsiniku positiivne külg tõmbub üksteise külge. Nukleofiil on negatiivne (või kergelt negatiivne) aatom, mis ründab teiste molekulide või ioonide positiivseid (või kergelt positiivseid) keskusi.
Grignardi reaktiivi, fenüülmagneesiumbromiidi valmistamine.
Grignardi reaktiividel on orgaanilises sünteesis juhtiv roll. Neid ühendeid saab kohandada paljude erinevate funktsionaalsete rühmade valmistamiseks ning magneesiumorgaaniliste derivaatide moodustamine ja reageerimine on üks peamisi alküülhalogeniidide kasutusalasid orgaanilises sünteesis. Halogeniidi ja magneesiumi reaktsioon toimub metalli pinnal ja on formaalselt metalli oksüdatsioon. Reaktsioon toimub tavaliselt kuivas eetris, kusjuures eeter toimib Lewis'i alusena, solvatiseerides Grignardi reaktiivi ja võimaldades tal difundeeruda metallist eemale. Metallorgaanilise reagendi moodustamine eeldab aktiivset pinda metallile ning metalli pinnal olevate metallide oksiidide tõttu võib reaktsiooni käivitamisel tekkida mõningaid raskusi. Magneesiumi lihvimine mörsis paar minutit enne kasutamist on sageli tõhus vahend puhta pinna saamiseks. Teine kasulik trikk reaktsiooni käivitamisel on väikese joodikristalli lisamine segule, mis reageerib magneesiumiga, moodustades väga reaktiivse magneesiumjodiidi (MgI2) soola.
Menetlus.
Grignardi reaktiivi valmistamiseks paigaldatakse esmalt kuiv 250 ml ümarpõhjaline kolb CaCl2 kuivatustoruga. Kolbi pannakse kasutatav magneesium (2 g = 0,082 mooli magneesiumipööret), kaltsiumkloriiditoru kinnitatakse otse ja kolbi kuumutatakse põhjalikult suure kuumutusmantli ja reostaadiga. Suurt kuumutusmantlit reguleeriv regulaator reguleeritakse asendisse "6" ja kolbi kuumutatakse, kuni see on liiga kuum, et seda sõrmega puudutada. Kolvi jahutamisel koguneb kuiv õhk läbi kaltsiumkloriidi. Enne jätkamist eemaldage küttekolb ja jahtuge toatemperatuurini (kolb peaks tunduma käes vaid veidi soojana või jahedamana). Eemaldage kaltsiumkloriidi kuivatustoru ja valage 250 ümara põhjaga kolbi 15 ml absoluutset eetrit ja 9 ml (13,5 g = 0,086 mooli) bromobenseeni. Asetage CaCl2 kuivatustoru tagasi. Kui reaktsioon ei avaldu kohe, käivitage reaktsioon, purustades mõned magneesiumipöörised. Selleks pannakse kuiv segamisvarras, mille ots on lapik ja purustatakse ettevaatlikult üks magneesiumitükk kindlalt kolvi põhja vastu vedeliku pinna alla, tehes varrasele keerutavaid liigutusi. Kui see on korralikult tehtud, muutub vedelik kergelt häguseks ja kokkusurutud metalli pinnal algab kiire mullimine. Sel hetkel lisatakse veel 25 ml absoluutset eetrit ning kolbi külge kinnitatakse tagasivoolukondensaator ja tagasivoolukondensaatori ülaosale CaCl2-toru, nagu on näidatud joonisel.
Ärge hakake vett läbi kondensaatori jooksma enne, kui eetriaurud on kondensaatori ülaosas asuvat ühendust niisutanud. Vajaduse korral jahutage kolbi, puudutades kolvi põhja jäävanniga, et reaktsiooni aeglustada, kuid ärge kasutage seda, kui see ei ole vajalik. See on vajalik ainult siis, kui eetriaurud väljuvad kuivatustoru ülaosast. Kui te peate reaktsiooni jahutama, siis olge ettevaatlik, et reaktsioon ei aeglustuks liiga palju, sest muidu võib reaktsioon seiskuda ja jää eemaldamisel mitte uuesti käivituda. Pöörake kolbi jõuliselt iga kuuekümne sekundi järel. Kui reaktsioon algab, võib spontaanne keemine lahjendatud segus olla aeglane või muutuda aeglaseks. Sellisel juhul lisage kolbi veel mõned ml bromobenseeni. Reaktsioon on lõppenud, kui eeter lõpetab mullimise ja alles jäävad vaid mõned väikesed metallijäänused. Märgistatakse kolvi eetri tase. Reaktsiooni ajal kontrollitakse, et eetri maht ei oleks vähenenud. Kui see on vähenenud, lisage veel kuiva eetrit. KunaGrignardi reaktiivi lahus halveneb seistes, tuleb kohe alustada järgmist etappi.
Grignardi reaktiivi kondenseerimine metüülbensoaadiga.
Grignardi reaktiivi kondenseerimine metüülbensoaadiga.
Segatakse 5 g (0,037 mooli; 1,09 g/ml) metüülbensoaati ja 15 ml absoluutset eetrit eraldussahvris, jahutatakse Grignardi reaktiivi lahust sisaldavat kolbi lühiajaliselt jäävannis. Eemaldage kuivatustoru ning sisestage Claiseni adapter ja eraldussahtel kondensaatori ülemisse ossa, nagu on näidatud paremal. Metüülbensoaadi lahus lastakse sisse tilkhaaval kümne minuti jooksul, kusjuures jahutatakse ainult niivõrd, kuivõrd see on vajalik eksotermilise reaktsiooni kontrollimiseks. Selle etapi käigus eraldub tootesool valge tahke aineena. Kolbi segatakse korrapäraselt, kuni reaktsioon on vaibunud ja kolb on toatemperatuuril. Edasiliigutakse otse järgmise sammu juurde.
Additsiooniprodukti hüdrolüüs.
Additsiooniprodukti hüdrolüüs.
Reaktsioonisegu valatakse ettevaatlikult 250 ml Erlenmeyeri kolbi, mis sisaldab 50 ml 10% väävelhapet ja umbes 25 g jääd. Reaktsioonikolbi loputamiseks kasutage mõned ml tavalist (mitteveevaba) eetrit ja mõned ml 10% väävelhapet. Lisage need loputused Erlenmeyeri kolbi. Segatakse hästi, et soodustada liitumisühendi hüdrolüüsi; aluselised magneesiumsoolad muutuvad vees lahustuvateks neutraalsooladeks ja trifenüülkarbinool jaotub eetrikihti. Täiendav kogus eetrit (tavalist) võib olla vajalik, kui teie esialgne eetrikiht on aurustumise tõttu muutunud liiga väikeseks. Te võite siinkohal lõpetada, kui järgmise osa lõpetamiseks ei ole piisavalt aega. Säilitage märgistatud Erlenmeyeri kübaras kergelt paigaldatud korgiga (mitte kummist). Kork peaks olema piisavalt lahtine, et areneva vesinikgaasi gaasirõhk vabaneks.
Kui tarbimata Mg-metall puutub kokku happega, tekib jõuline vesinikgaasi areng ja reaktsioonisegu võib vahustada, kui lisamine on liiga kiire.
Toote eraldamine.
Kui teie eetrikihis on tahked valged kristallid, on need tootekristallid, mis on tekkinud, sest osa eetrikihist on aurustunud. Need kristallid võib eraldada, valades segu eraldussahtrisse läbi klaassahvri, mille varre on asetatud väike klaasvillast kork. Kristallid loputatakse väikese koguse eetrilahustiga. Ülejäänud toote eraldamiseks loputage Erlenmeyeri kolbi, millest valasite algse lahuse, mõne ml tavalise eetriga ja lisage see eraldussahtrisse. Loksutatakse lehtrit, tagades hoolikalt, et gaasikogunemine lehtrisse oleks eemaldatud. Tõmmake vesikiht ära. Eetrikihti raputatakse 10-protsendilise väävelhappega, et eemaldada magneesiumsoolad ja eemaldada väävelhappekiht. Eetrikiht pestakse küllastunud naatriumkloriidi lahusega, et eemaldada eetris lahustunud vesi. Eemaldatakse naatriumkloriidi lahus. Nendes pesutoimingutes kasutatav vedelikukogus ei ole kriitiline. Üldiselt on piisav pesuvedeliku kogus, mis on võrdne ühe kolmandiku eetri mahust. Eetrilahuse lõplikuks kuivatamiseks valatakse eetrikiht eraldussahvri kaelast Erlenmeyeri kolbi, lisatakse umbes 5 g granuleeritud veevaba naatriumsulfaati, mida aeg-ajalt segatakse kolbi ja 5 minuti pärast dekanteeritakse eeter tahkest kuivatusainest teise puhtasse ja kuiva Erlenmeyeri kolbi. Eetrilahusele lisatakse 25 ml ligroiini ja kolb suletakse korgiga. Laske segul seista üle öö või kuni järgmise laboratoorse ajani. Pärast seismist peaksid olema moodustunud trifenüülkarbinooli kristallid. Peamine lisand bifenüül peaks jääma ümberkristallisatsioonilahustisse lahustuvaks. Filtreeritakse kristallid imufiltreerimise teel, kuni need on kuivad. Registreeritakse isoleeritud toote kaal ja arvutatakse saagise %. Võetakse sulamistemperatuur.
Kui tarbimata Mg-metall puutub kokku happega, tekib jõuline vesinikgaasi areng ja reaktsioonisegu võib vahustada, kui lisamine on liiga kiire.
Toote eraldamine.
Kui teie eetrikihis on tahked valged kristallid, on need tootekristallid, mis on tekkinud, sest osa eetrikihist on aurustunud. Need kristallid võib eraldada, valades segu eraldussahtrisse läbi klaassahvri, mille varre on asetatud väike klaasvillast kork. Kristallid loputatakse väikese koguse eetrilahustiga. Ülejäänud toote eraldamiseks loputage Erlenmeyeri kolbi, millest valasite algse lahuse, mõne ml tavalise eetriga ja lisage see eraldussahtrisse. Loksutatakse lehtrit, tagades hoolikalt, et gaasikogunemine lehtrisse oleks eemaldatud. Tõmmake vesikiht ära. Eetrikihti raputatakse 10-protsendilise väävelhappega, et eemaldada magneesiumsoolad ja eemaldada väävelhappekiht. Eetrikiht pestakse küllastunud naatriumkloriidi lahusega, et eemaldada eetris lahustunud vesi. Eemaldatakse naatriumkloriidi lahus. Nendes pesutoimingutes kasutatav vedelikukogus ei ole kriitiline. Üldiselt on piisav pesuvedeliku kogus, mis on võrdne ühe kolmandiku eetri mahust. Eetrilahuse lõplikuks kuivatamiseks valatakse eetrikiht eraldussahvri kaelast Erlenmeyeri kolbi, lisatakse umbes 5 g granuleeritud veevaba naatriumsulfaati, mida aeg-ajalt segatakse kolbi ja 5 minuti pärast dekanteeritakse eeter tahkest kuivatusainest teise puhtasse ja kuiva Erlenmeyeri kolbi. Eetrilahusele lisatakse 25 ml ligroiini ja kolb suletakse korgiga. Laske segul seista üle öö või kuni järgmise laboratoorse ajani. Pärast seismist peaksid olema moodustunud trifenüülkarbinooli kristallid. Peamine lisand bifenüül peaks jääma ümberkristallisatsioonilahustisse lahustuvaks. Filtreeritakse kristallid imufiltreerimise teel, kuni need on kuivad. Registreeritakse isoleeritud toote kaal ja arvutatakse saagise %. Võetakse sulamistemperatuur.
Psühhoaktiivsete ainete sünteesid Grignardi reaktiiviga.
Grignardi reaktiivi kasutatakse mitmete pindaktiivsete ainete sünteesimisel. Näiteks sünteetiliste kannabinoidide sünteesimisel alküülrühma sidumiseks indooli lämmastiku aatomiga (vt JWH-018 sünteesi näide). Reaktsioon kulgeb üsna kiiresti kergetes tingimustes ja ei nõua kuumutamist.
Grignardi reaktiivi nukleofiilne liitumine võimaldab mõningaid mittespetsiifilisi ja stereospetsiifilisi reaktsioone amfetamiini ja selle lähteaine, näiteks fenüül-2-propanooni (P2P)tootmiseks .
Teine Grignardi reaktiivi kasutusviis on kasutamine mefedrooni (4-MMC) sünteesiteel , kasutades lähteainena 4-metüülbensaldehüüdi.
Indolüülmagneesiumjodiidi reageerimine asendatud alküülhalogeniididega, nt nitriilidega Cl(CH2)nCN ja klooratsetüül dietüülamiidiga, vastavate 3-substitutsiooniliste indoolide saamiseks on hästi teada, kuigi väga reaktiivsed halogeniidid, nagu metüüljodiid ja bensüülkloriid, annavad mõnikord 1,3-disubstitutsioonilisi indoole. See DMT marsruut on võimalik Grignardi reaktiivi abil.
Lisakseelnevatele erinevatele rakendustele kasutatakse seda populaarset lähenemisviisi ketamiini sünteesi etapis (o-klorofenüül)-tsüklopentüülketooni valmistamisel.
Järeldus.
Nagu näete, kasutatakse Grignardi reaktiivi ulatuslikult orgaanilistes sünteesides ja ravimite tootmises osaliselt. Alkülimagneesiumhalogeniidid (mida nimetatakse ka Grignardi reaktiivideks) toimivad nagu nukleofiilid, rünnates elektrofiilset süsinikuaatomit, et moodustada süsinik-süsinik sidet. Grignardi reaktsioon on oluline meetod nii süsinik-süsiniku sidemete kui ka süsinik-heteroatomi sidemete loomiseks. See nimekiri kõige populaarsematest reaktsioonidest salakeemikute seas näitab Grignardi reaktiivide rakendamise tohutut potentsiaali ja kujutab endast suurt uurimisvaldkonda.
Last edited:
