G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,991
- Solutions
- 3
- Reaction score
- 3,378
- Points
- 113
- Deals
- 1
Johdanto
Miten muuttaa grammat millilitroiksi ja päinvastoin?
Mikä on mooli?
Mikä on moolimassa?
Miten muunnetaan mooli grammoiksi ja päinvastoin?
Toinen esimerkki: reaktioon on lisättävä 10 moolia natriumboorihydridiä (NaBH4), jonka molekyylimassa on 37,83 g/mol, ja sinun on laskettava se grammoina:
Miten reagenssit lasketaan?
Miten laskea reaktion saanto?
Laske sitten, kuinka monta moolia puuttuvaa reagenssia (tässä esimerkissä P2P) osallistuu reaktioon.
Saan paljon samoja kysymyksiä reaktioiden saannoista, reagenssien määrästä ja siitä, miten yksi ulottuvuus käännetään toiseen, ja huomaan, että ihmiset eivät osaa laskea näitä yksinkertaisia mutta erittäin tärkeitä lukuja oikein. Päätin kuvata oikeat menetelmät tässä aiheessa. Jos et ymmärrä jotain, älä epäröi kysyä ja keskustella kysymyksistäsi kommenttiosassa.
Miten muuttaa grammat millilitroiksi ja päinvastoin?
Gramma (SI-yksikkötunnus g) on kansainvälisen yksikköjärjestelmän(SI) massayksikkö, joka vastaa yhtä kilogramman tuhannesosaa (1/1000). Gramma on puhtaan veden tilavuuden absoluuttinen paino, joka vastaa metrin sadasosan kuutiota [1 cm3], ja sulavan jään lämpötilassa, määrittelylämpötila (~0 °C) muutettiin myöhemmin 4 °C:ksi, veden tiheyden maksimilämpötilaksi.
Muuntokertoimet
Muuntokertoimet
- 1 gramma (g) = 15,4323583529 jyvää (gr).
- 1 jyvä (gr) = 0,06479891 grammaa.
- 1 avoirdupois-unssi (oz) = 28,349523125 grammaa.
- 1 troy-unssi (ozt) = 31,1034768 grammaa.
- 100 grammaa (g) = 3,527396195 unssia (oz).
- 1 karaatti (ct) = 0,2 grammaa.
- 1 gamma (γ) = 10-6 grammaa.
- 1 undekimogrammi = 1 "yhdestoista gramma" = 10-11 grammaa historiallisessa kvadrantti-yksitoista grammaa-sekuntijärjestelmässä (QES-järjestelmä) eli hebdometri- ja desimogrammi-sekuntijärjestelmässä (HUS-järjestelmä).
- 500 grammaa (g) = 1 jin kiinalaisissa mittayksiköissä.
Litra (kansainvälinen kirjoitusasu) tai litra (amerikanenglantilainen kirjoitusasu), SI-tunnukset L ja l. Litra on metrinen tilavuusyksikkö. Se vastaa 1 kuutiodesimetriä (dm3), 1000 kuutiosenttimetriä (cm3) tai 0,001 kuutiometriä (m3). Kuutiodesimetri (tai litra) on tilavuudeltaan 10 cm × 10 cm × 10 cm (ks. kuva) ja vastaa siten kuutiometrin tuhannesosaa. Millilitra, SI-tunnus ml tai ml on kuutiosenttimetri. Kuutiosenttimetri (tai ml) on tilavuudeltaan 1 cm × 1 cm × 1 cm ja vastaa siten yhtä litran tuhannesosaa (1/1000).
Muuntokertoimet

Muuntokertoimet
- 1 Imperial quart = 1,1365225 L.
- 1 US-kvartti = 0,946352946 L.
- 1 Imperial pint = 0,56826125 L.
- 1 U.S. pint = 0,473176473 L.
- 1 Imperial gallon = 4,54609 L.
- 1 Yhdysvaltain gallonaa = 3,785411784 L.
- 1 kuutiojalka = 28,316846592 L.
- 1 kuutiotuuma = 0,016387064 L.
- 1 brittiläinen nesteunssia = 28,4130625 ml.
- 1 yhdysvaltalainen nesteunssin = 29,5735295625 ml.
Grammat voidaan helposti muuttaa millilitroiksi tämän kaavan mukaan.
V = m / ρ.
jossa m - aineen massa, g; ρ - aineen tiheys, g/ml; V - aineen tilavuus.
Tämän kaavan mukaan voit muuttaa jokaisen aineen tilavuudeksi ja päinvastoin. Esimerkiksi sinulla on 20 g elohopeaa (Hg) ja haluat laskea sen massan. ρ (elohopean tiheys) on 13,5 g/ml, eli
Tämän kaavan mukaan voit muuttaa jokaisen aineen tilavuudeksi ja päinvastoin. Esimerkiksi sinulla on 20 g elohopeaa (Hg) ja haluat laskea sen massan. ρ (elohopean tiheys) on 13,5 g/ml, eli
V(Hg) = 20 g / 13,5 g/ml = 1,48 ml.
1,48 ml on 20 g elohopean tilavuus.
Mikä on mooli?
Mooli, symboli mol, n, on aineen määrän yksikkö kansainvälisessä yksikköjärjestelmässä (SI). Aineen määrä on mitta, joka kertoo, kuinka monta alkeisyksikköä tiettyä ainetta on esineessä tai näytteessä (missä tahansa aineessa). Mooli määritellään siten, että se sisältää täsmälleen 6,02214085774 × 10²³ hiukkasia (atomeja, molekyylejä, ioneja, elektroneja tai muita kohteita). Esimerkiksi 10 moolia vettä (kemiallinen yhdiste H2O) ja 10 moolia elohopeaa (kemiallinen alkuaine Hg) sisältävät yhtä paljon ainetta, ja elohopeassa on tasan yksi atomi jokaista veden molekyyliä kohden, vaikka näiden kahden tilavuus ja massa ovatkin erilaiset. Joka tapauksessa se on aika paljon, eikö olekin? Tästä syystäon kätevämpää osata muuntaa grammat mooleiksi kuin grammat atomien lukumääräksi.
Mikä on moolimassa?
Molarimassa on aineen ominaisuus, aineen massan ja sen määrän suhde. Numeerisesti yhtä suuri kuin 1 mooli aineen massa, eli aineen massa sisältää Avogadron lukua vastaavan määrän hiukkasia. Molaarinen massa, ilmaistuna g/mol, on numeerisesti sama kuin molekyylimassa, ilmaistuna r.a.m., ja suhteellinen atomimassa. Molaarisen massan ja molekyylimassan välillä on kuitenkin ero, ne ovat vain numeerisesti yhtä suuria ja eroavat toisistaan ulottuvuuksiltaan.
Esimerkiksi hapen molaarinen massa alkuaineena M(O) = 16 g/mol, mutta molekyyleistä koostuvana yksinkertaisena aineena O2 = 32 g/mol.
Monimutkaisten molekyylien molaariset massat voidaan määrittää laskemalla yhteen niiden muodostavien alkuaineiden molaariset massat. Esimerkiksi veden H2O molekyylimassa on.
Esimerkiksi hapen molaarinen massa alkuaineena M(O) = 16 g/mol, mutta molekyyleistä koostuvana yksinkertaisena aineena O2 = 32 g/mol.
Monimutkaisten molekyylien molaariset massat voidaan määrittää laskemalla yhteen niiden muodostavien alkuaineiden molaariset massat. Esimerkiksi veden H2O molekyylimassa on.
M(H2O) = 2 x M(H) + M(O) = 2 x 1 g/mol + 16 g/mol = 18 g/mol.
Miten muunnetaan mooli grammoiksi ja päinvastoin?
Jos haluat arvioida oikein tietyn massan m (grammoina) omaavan aineen moolimäärän n, sinun on noudatettava kaavaa, jossa grammat muutetaan mooleiksi.
n = m / M.
missä: M - aineen moolimassa. Yksikkö on yleensä g/mol; m - aineen massa, g; n - aineen moolimassa, mol.
Esimerkiksi sinulla on 100 g P2NP:tä, jonka moolimassa on 163,17 g/mol. Sinun on laskettava, kuinka monta moolia se on. Yllä olevan kaavan mukaan.
Esimerkiksi sinulla on 100 g P2NP:tä, jonka moolimassa on 163,17 g/mol. Sinun on laskettava, kuinka monta moolia se on. Yllä olevan kaavan mukaan.
n(P2NP) = 100 g / 163,17 g/mol = 0,6129 moolia.
Toinen esimerkki: reaktioon on lisättävä 10 moolia natriumboorihydridiä (NaBH4), jonka molekyylimassa on 37,83 g/mol, ja sinun on laskettava se grammoina:
m(NaBH4) = 10 moolia x 37,83 g/mol = 378,3 g.
Miten reagenssit lasketaan?
Olet avannut synteesin käsikirjan ja huomannut, että tarvitset paljon vähemmän tai suuremman mittakaavan synteesiä. Olet hämmentynyt numeroista etkä tiedä, miten laskea ne mittakaavaan? Tähän on selitys.
Jos haluat kasvattaa synteesin mittakaavaa ja olet varma, että se on mahdollista tehdä lineaarisen riippuvuuden mukaisesti, sinun on vain kerrottava kaikki reagenssimäärät samalla indeksillä. Saat reagenssimäärät synteesin mittakaavaan, eikä sinun tarvitse kysyä asiantuntijalta tästä!
Esimerkki: haluat tehdä amfetamiinisynteesin NaBH4/CuCl2:n avulla ja sinun on otettava 1000 g P2NP:tä tätä synteesiä varten BB-foorumilta löytyvän käyttöohjeen mukaisesti. Haluat suorittaa 150 g P2NP-synteesikuormaa. Algoritmisi on.
Jos haluat kasvattaa synteesin mittakaavaa ja olet varma, että se on mahdollista tehdä lineaarisen riippuvuuden mukaisesti, sinun on vain kerrottava kaikki reagenssimäärät samalla indeksillä. Saat reagenssimäärät synteesin mittakaavaan, eikä sinun tarvitse kysyä asiantuntijalta tästä!
Esimerkki: haluat tehdä amfetamiinisynteesin NaBH4/CuCl2:n avulla ja sinun on otettava 1000 g P2NP:tä tätä synteesiä varten BB-foorumilta löytyvän käyttöohjeen mukaisesti. Haluat suorittaa 150 g P2NP-synteesikuormaa. Algoritmisi on.
1. Jaa käsikirjassa kuvattu 1000 g P2NP:n pääprekursorin määrä 150 g:lla ja saat tarvittavan indeksin 6,67.
2. Jaa kaikki reagenssimäärät 6,67:llä ja pääset tavoitteeseesi.
Jos sinun täytyy skaalata tämä synteesikuorma 1000 g P2NP:stä 2500 g:aan, noudata näitä ohjeita.
1. Jaa 2500 g P2NP:tä 1000 g:lla ja saat indeksin 2,5.
2. Kerro kaikki reagenssit 2,5:llä ja pääset tavoitteeseesi.
Miten laskea reaktion saanto?
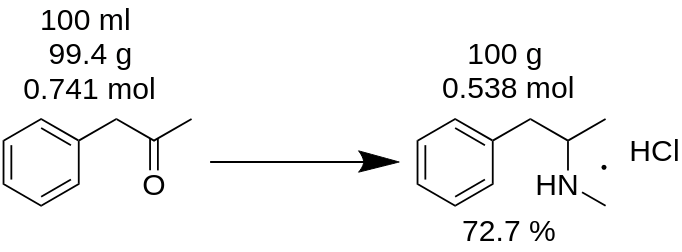
Olet suorittanut metamfetamiinihydrokloridisynteesin 100 ml:sta P2P:tä ja saanut 100 g tuotetta. Luuletko, että sait 100 % saannon? Se on väärin!
Esimerkki.
Esimerkki.
Ensiksisinun on laskettava synteesiin käytetyn P2P:n massa.
m(P2P) = 100 ml / 1,006 = 99,4 g.
Laske sitten, kuinka monta moolia puuttuvaa reagenssia (tässä esimerkissä P2P) osallistuu reaktioon.
n(P2P) = 99,4 g / 134,178 g/mooli = 0,741 moolia.
Puutosreagenssi on reagenssi, joka osallistuu reaktioon ja jonka moolimäärä on pienin. Esimerkiksi P2P:n reduktiivisessa aminoitumisreaktiossa metamfetamiiniksi tarvitaan 1 mooli P2P:tä ja ~3,5 moolia metyyliamiinia. P2P on tässä reaktiossa reagenssin puute.
Reaktiotasapainon mukaan 1 mooli P2P:tä antaa 1 mooli metamfetamiinihydrokloridia. Näin ollen 0,741 moolia P2P:tä antaa 0,741 moolia metamfetamiinihydrokloridia (MH),joka on
Reaktiotasapainon mukaan 1 mooli P2P:tä antaa 1 mooli metamfetamiinihydrokloridia. Näin ollen 0,741 moolia P2P:tä antaa 0,741 moolia metamfetamiinihydrokloridia (MH),joka on
m(MH) = 0,741 moolia x 185,69 g/mooli = 137,56 g.
jossa 185,69 g/mooli on metamfetamiinihydrokloridin molekyylimassa.
Teoreettinen saanto. Teoreettinen saanto on aineen määrä, joka on saatava reaktiotuloksena. Näin ollen reaktion saanto voidaan laskea teoreettisesta tuloksesta.
Teoreettinen saanto. Teoreettinen saanto on aineen määrä, joka on saatava reaktiotuloksena. Näin ollen reaktion saanto voidaan laskea teoreettisesta tuloksesta.
Saanto, % = (m(teoria)*100)/m(käytäntö),
Saanto (MH) = (100 g * 100) / 137,56 = 72,7 %.
Saanto (MH) = (100 g * 100) / 137,56 = 72,7 %.
Kuten näet, todellinen saanto 72,7 % on todella erilainen kuin 100 %:n saanto, joka laskettiin virheellisesti reaktiomassan perusteella. Sillä onmerkittävä rooli minkä tahansa aineen tuotannossa.
Last edited:
