@G.Patton Uskon, että yksi tämän synteesin (ja alkuperäisen rodium-artikkelin) piirretyistä välituotteista on virheellinen.
(3), amfetamiini-formaldehydi-imiini-välituotteen esitys omaa saman rakenteen kuin fenyyliasetoni-metyyliamiini-imiini, joka on nähtävissä muualla
tämä ei vaikuta minusta oikealta kahdesta syystä: ensinnäkin, piirtämällä substraatin imiinin muodostumisen standardimekanismi tuottaa imiinin, jossa kaksoissidos on N:n ja metamfetamiinin tulevan metyyliryhmän välillä, eikä N:n ja alfahiilen välillä, kuten luetellussa rakenteessa. ja ajattele asiaa: kaksoissidos syntyy, kun amiinin yksinäinen pari potkaisee formaldehydin hapen päällä muodostuneen veden pois lähteväksi ryhmäksi, minkä on tapahduttava formaldehydin (tulevan metyyliryhmän) puolelta.
Toiseksi, synteesi ilmoitetaan stereospesifiseksi lähtösubstraatin perusteella. toisin sanoen d-amf:n pelkistäminen tuottaa d-metyyliä ja sama koskee l-isomeeria. esitetyssä rakenteessa (3) ei ole kiraalisia keskuksia, ja sen pelkistäminen vastaa tavanomaista fenyyliasetonin reduktiivista aminoitumista, joka tuottaa raseemisen tuotteen. antamassani välituotteen ehdotetussa rakenteessa on kiraalisia keskuksia, jotka ovat samat kuin lähtöaineen keskukset, ja ne vastaavat näin ollen havaittua reaktion stereospesifisyyttä.
Jos olen oikeassa, tämä selventäisi reaktion stereospesifisyyttä koskevat kysymykset, jotka esitettiin aiemmin tässä ketjussa. Jos olen tehnyt virheen jossain, pyydän anteeksi, mutta olin utelias, miksi ei-kiraalisen (3) pelkistäminen johtaa ei-raskeemiseen tuoteseokseen, kun käytetään ei-raskeemista amfetamiinin lähtöainetta.
(3), amfetamiini-formaldehydi-imiini-välituotteen esitys omaa saman rakenteen kuin fenyyliasetoni-metyyliamiini-imiini, joka on nähtävissä muualla
tämä ei vaikuta minusta oikealta kahdesta syystä: ensinnäkin, piirtämällä substraatin imiinin muodostumisen standardimekanismi tuottaa imiinin, jossa kaksoissidos on N:n ja metamfetamiinin tulevan metyyliryhmän välillä, eikä N:n ja alfahiilen välillä, kuten luetellussa rakenteessa. ja ajattele asiaa: kaksoissidos syntyy, kun amiinin yksinäinen pari potkaisee formaldehydin hapen päällä muodostuneen veden pois lähteväksi ryhmäksi, minkä on tapahduttava formaldehydin (tulevan metyyliryhmän) puolelta.
Toiseksi, synteesi ilmoitetaan stereospesifiseksi lähtösubstraatin perusteella. toisin sanoen d-amf:n pelkistäminen tuottaa d-metyyliä ja sama koskee l-isomeeria. esitetyssä rakenteessa (3) ei ole kiraalisia keskuksia, ja sen pelkistäminen vastaa tavanomaista fenyyliasetonin reduktiivista aminoitumista, joka tuottaa raseemisen tuotteen. antamassani välituotteen ehdotetussa rakenteessa on kiraalisia keskuksia, jotka ovat samat kuin lähtöaineen keskukset, ja ne vastaavat näin ollen havaittua reaktion stereospesifisyyttä.
Jos olen oikeassa, tämä selventäisi reaktion stereospesifisyyttä koskevat kysymykset, jotka esitettiin aiemmin tässä ketjussa. Jos olen tehnyt virheen jossain, pyydän anteeksi, mutta olin utelias, miksi ei-kiraalisen (3) pelkistäminen johtaa ei-raskeemiseen tuoteseokseen, kun käytetään ei-raskeemista amfetamiinin lähtöainetta.
Hei. Ensinnäkin a-hiilellä on suurempi elektronitiheys kuin metyylihiilellä. Tyypillinen mekanismi johtaa tällaiseen välituotteeseen (piilotettu Breaking Bad -vesileiman alle, sry):
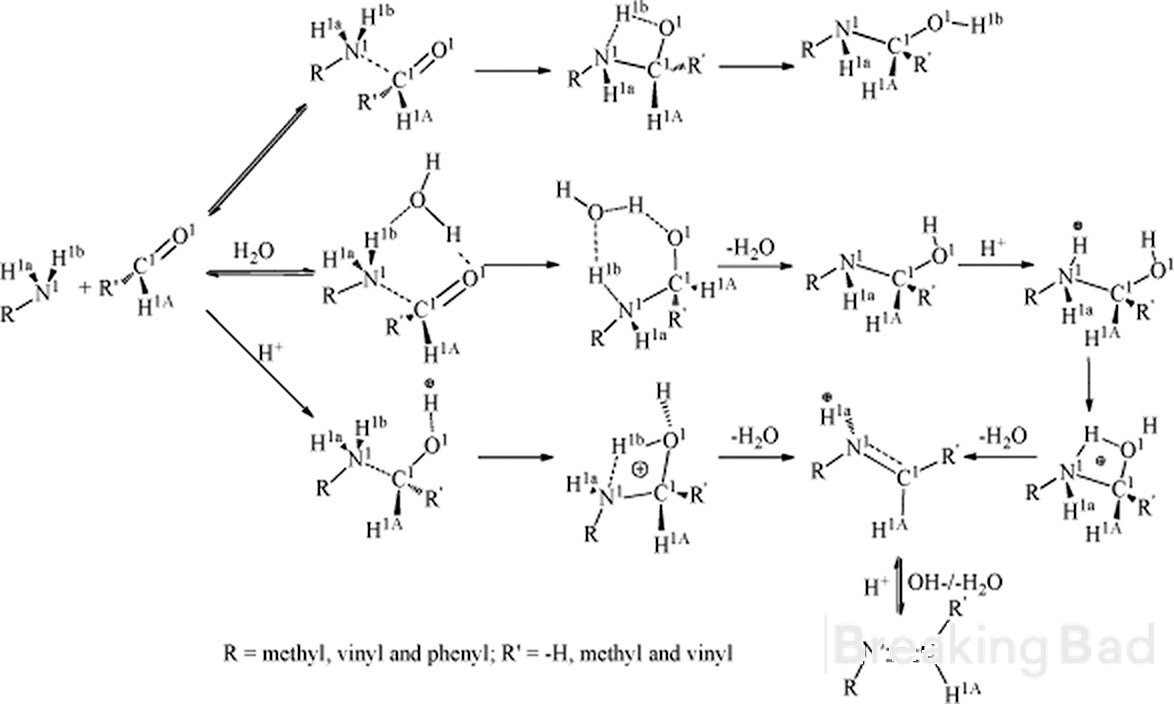
Toiseksi, onko teillä luotettavaa tietoa tämän synteesin stereospesifisestä tuloksesta?
Toiseksi, onko teillä luotettavaa tietoa tämän synteesin stereospesifisestä tuloksesta?
↑View previous replies…
- By NexusPrime
rhodium on virhe, kaksoissidos ei ole siellä, ks. esimerkki bentsaldehydin kanssa jäljempänä
