G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,954
- Solutions
- 3
- Reaction score
- 3,323
- Points
- 113
- Deals
- 1
Introduction
Comment transformer des grammes en millilitres et vice versa ?
Qu'est-ce que le nombre de moles ?
Qu'est-ce que la masse molaire ?
Comment transformer des moles en grammes et vice versa ?
Autre exemple, vous devez ajouter 10 moles de borohydrure de sodium (NaBH4) d'une masse moléculaire de 37,83 g/moles à la réaction et vous devez les compter en grammes :
Comment compter les réactifs ?
Comment calculer le rendement d'une réaction ?
Ensuite, il faut compter combien de moles d'un réactif manquant (le P2P dans cet exemple) participent à la réaction.
Je reçois beaucoup de questions sur les rendements des réactions, les quantités de réactifs, la façon de passer d'une dimension à une autre et je remarque que les gens ne savent pas comment compter correctement ces nombres simples mais très importants. J'ai décidé de décrire les méthodes correctes dans cette rubrique. Si vous ne comprenez pas quelque chose, n'hésitez pas à poser vos questions et à en discuter dans la section des commentaires.
Comment transformer des grammes en millilitres et vice versa ?
Le gramme (symbole SI g) est une unité de masse du Systèmeinternational d' unités(SI) égale à un millième de kilogramme (1/1000). Legramme est le poids absolu d'un volume d'eau pure égal au cube de la centième partie d'un mètre [1 cm3], et à la température de la glace fondante, la température de définition (~0 °C) a ensuite été modifiée en 4 °C, la température de la densité maximale de l'eau.
Facteurs de conversion
Facteurs de conversion
- 1 gramme (g) = 15,4323583529 grains (gr).
- 1grain (gr) = 0,06479891 gramme.
- 1once avoirdupois (oz) = 28,349523125 grammes.
- 1 oncetroy (ozt) = 31,1034768 grammes.
- 100 grammes (g) = 3,527396195 onces (oz).
- 1 carat (ct) = 0,2 gramme.
- 1gamma (γ) = 10-6 grammes.
- 1undécimogramme = 1 "onzième gramme" = 10-11 grammes dans le système historique quadrant-eleventh-gram-second (système QES) alias système hebdomètre-undécimogramme-second (système HUS).
- 500 grammes (g) = 1 jin dans les unités de mesure chinoises.
Le litre (orthographe internationale) ou liter (orthographe américaine), symboles SI L et l. Le litre est une unité métrique de volume. Il est égal à 1 décimètre cube (dm3), 1000 centimètres cubes (cm3) ou 0,001 mètre cube (m3). Un décimètre cube (ou litre) occupe un volume de 10 cm × 10 cm × 10 cm (voir figure) et est donc égal à un millième de mètre cube. Le millilitre, symbole SI ml ou mL est un centimètre cube. Un centimètre cube (ou ml) occupe un volume de 1 cm × 1 cm × 1 cm et est donc égal à un millième de litre (1/1000).
Facteurs de conversion

Facteurs de conversion
- 1 pinte impériale = 1,1365225 L.
- 1 pinte américaine =0,946352946 L.
- 1pinte impériale = 0,56826125 L.
- 1 pinte américaine = 0,473176473 L.
- 1gallon impérial = 4,54609 L.
- 1 gallonaméricain = 3,785411784 L.
- 1pied cube = 28,316846592 L.
- 1 pouce cube= 0,016387064 L.
- 1 once liquide impériale = 28,4130625 ml.
- 1 once liquide américaine= 29,5735295625 ml.
Lesgrammes peuvent être facilement convertis en millilitres selon la formule suivante.
V = m / ρ.
où m - masse de la substance, g ; ρ - densité de la substance, g/ml ; V - volume de la substance.
Cette formule permet de convertir toute substance en volume et vice versa. Par exemple,vous avez 20 g de mercure (Hg) et vous voulez calculer sa masse. ρ (densité) du mercure est de 13,5 g/ml, donc
Cette formule permet de convertir toute substance en volume et vice versa. Par exemple,vous avez 20 g de mercure (Hg) et vous voulez calculer sa masse. ρ (densité) du mercure est de 13,5 g/ml, donc
V(Hg) = 20 g / 13,5 g/ml = 1,48 ml
1,48 ml est le volume de 20 g de mercure.
Qu'est-ce que le nombre de moles ?
La mole, symbole mol, n, est l'unité de quantité de substance dans le système international d'unités (SI). La quantité de substance est une mesure du nombre d'entités élémentaires d'une substance donnée dans un objet ou un échantillon (dans n'importe quelle substance). La mole est définie comme contenant exactement 6,02214085774 × 10²³ particules (atomes, molécules, ions, électrons ou tout autre objet). Par exemple, 10 moles d'eau (un composé chimique H2O) et 10 moles de mercure (un élément chimique Hg) contiennent des quantités égales de substance et le mercure contient exactement un atome pour chaque molécule d'eau, bien que les deux aient des volumes et des masses différents. Bref, c'est beaucoup, n'est-ce pas ? C'est pourquoi il estplus pratique de savoir convertir les grammes en moles plutôt que les grammes en nombre d'atomes.
Qu'est-ce que la masse molaire ?
La masse molaire est une caractéristique d'une substance, le rapport entre la masse d'une substance et sa quantité. Numériquement égale à la masse d'une mole d'une substance, c'est-à-dire que la masse d'une substance contient un nombre de particules égal au nombre d'Avogadro. La masse molaire, exprimée en g/mol, coïncide numériquement avec la masse moléculaire, exprimée en r.a.m., et la masse atomique relative. Cependant, il existe une différence entre la masse molaire et la masse moléculaire, elles sont numériquement égales et diffèrent en dimension.
Par exemple, la masse molaire de l'oxygène en tant qu'élément M(O) = 16 g/mol, mais en tant que substance simple composée de molécules O2 = 32 g/mol.
Les masses molaires des molécules complexes peuvent être déterminées en additionnant les masses molaires de leurs éléments constitutifs. Par exemple, la masse moléculaire de l'eau H2O est la suivante.
Par exemple, la masse molaire de l'oxygène en tant qu'élément M(O) = 16 g/mol, mais en tant que substance simple composée de molécules O2 = 32 g/mol.
Les masses molaires des molécules complexes peuvent être déterminées en additionnant les masses molaires de leurs éléments constitutifs. Par exemple, la masse moléculaire de l'eau H2O est la suivante.
M(H2O) = 2 x M(H) + M(O) = 2 x 1 g/mol + 16 g/mol = 18 g/mol.
Comment transformer des moles en grammes et vice versa ?
Pour évaluer correctement le nombre de moles, n, d'une substance d'une masse spécifique, m, (en grammes), vous devez suivre la formule de conversion des grammes en moles.
n = m / M.
où : M - la masse molaire de cette matière. L'unité est généralement g/mol ; m - masse de la substance, g ; n - moles de la substance, mol.
Par exemple, vous avez 100 g de P2NP, dont la masse moléculaire est de 163,17 g/mol. Vous devez calculer le nombre de moles que cela représente. Selon la formule ci-dessus.
Par exemple, vous avez 100 g de P2NP, dont la masse moléculaire est de 163,17 g/mol. Vous devez calculer le nombre de moles que cela représente. Selon la formule ci-dessus.
n(P2NP) = 100 g / 163,17 g/mol = 0,6129 moles.
Autre exemple, vous devez ajouter 10 moles de borohydrure de sodium (NaBH4) d'une masse moléculaire de 37,83 g/moles à la réaction et vous devez les compter en grammes :
m(NaBH4) = 10 moles x 37,83 g/mol = 378,3 g.
Comment compter les réactifs ?
Vous avez ouvert le manuel de synthèse et vous vous êtes rendu compte que vous aviez besoin d'une synthèse à plus petite ou plus grande échelle. Les chiffres vous déroutent et vous ne savez pas comment les compter à votre échelle ? Il y a une explication.
Si vous voulez augmenter l'échelle d'une synthèse et que vous êtes sûr qu'il est possible de le faire selon la dépendance linéaire, il suffit de multiplier toutes les quantités de réactifs par le même indice. Vous obtiendrez les quantités de réactifs pour votre échelle de synthèse et vous n'avez pas besoin de demander à un expert à ce sujet !
Exemple : vous voulez effectuer la synthèse de l'amphétamine via NaBH4/CuCl2 et vous devez prendre 1000 g de P2NP pour cette synthèse selon le manuel du forum BB. Vous voulez effectuer une charge de synthèse de 150 g de P2NP. Votre algorithme est le suivant
Si vous voulez augmenter l'échelle d'une synthèse et que vous êtes sûr qu'il est possible de le faire selon la dépendance linéaire, il suffit de multiplier toutes les quantités de réactifs par le même indice. Vous obtiendrez les quantités de réactifs pour votre échelle de synthèse et vous n'avez pas besoin de demander à un expert à ce sujet !
Exemple : vous voulez effectuer la synthèse de l'amphétamine via NaBH4/CuCl2 et vous devez prendre 1000 g de P2NP pour cette synthèse selon le manuel du forum BB. Vous voulez effectuer une charge de synthèse de 150 g de P2NP. Votre algorithme est le suivant
1. Divisez 1000 g de la quantité de précurseur principal P2NP décrite dans le manuel par 150 g et vous obtiendrez l'indice nécessaire 6,67.
2. Diviseztoutes les quantités de réactifs par 6,67 et vous atteindrez votre objectif.
Si vous devez augmenter cette charge de synthèse de 1000 g de P2NP à 2500 g, suivez les instructions suivantes.
1. Divisez 2500 g de P2NP par 1000 g et vous obtiendrez l'indice 2,5.
2. Multipliez tous les réactifs par 2,5 et vous atteindrez votre objectif.
Comment calculer le rendement d'une réaction ?
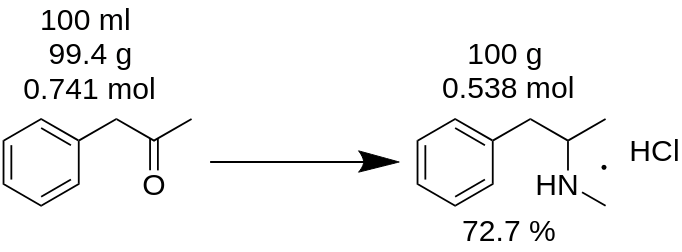
Vous avez réalisé la synthèse du chlorhydrate de méthamphétamine à partir de 100 ml de P2P et obtenu 100 g de produit. Vous pensez avoir obtenu un rendement de 100 % ? C'estfaux !
Exemple.
Exemple.
Tout d'abord, vous devez compter la masse de P2P, qui a été utilisée pour cette synthèse.
m(P2P) = 100 ml / 1,006 = 99,4g
Ensuite, il faut compter combien de moles d'un réactif manquant (le P2P dans cet exemple) participent à la réaction.
n(P2P) = 99,4 g / 134,178 g/mole = 0,741 moles.
Un réactif manquant est un réactif qui participe à la réaction et dont la quantité en moles est la plus faible. Par exemple, dans la réaction d'amination réductrice du P2P en méthamphétamine, vous devez prendre 1 mole de P2P et ~3,5 moles de méthylamine. Le P2P est le réactif manquant dans cette réaction.
D'après le bilan de la réaction, 1 mole de P2P donne 1 mole de chlorhydrate de méthamphétamine. Par conséquent, 0,741 moles de P2P donne 0,741 moles de chlorhydrate de méthamphétamine (MH), soit
D'après le bilan de la réaction, 1 mole de P2P donne 1 mole de chlorhydrate de méthamphétamine. Par conséquent, 0,741 moles de P2P donne 0,741 moles de chlorhydrate de méthamphétamine (MH), soit
m(MH) = 0,741 moles x 185,69 g/mole = 137,56 g.
où 185,69 g/mole est la masse moléculaire du chlorhydrate de méthamphétamine.
Il s'agit du rendement théorique. Le rendement théorique est la quantité de substance qui doit être obtenue comme résultat de la réaction. Parconséquent, vous pouvez calculer le rendement de la réaction à partir de ce résultat théorique.
Il s'agit du rendement théorique. Le rendement théorique est la quantité de substance qui doit être obtenue comme résultat de la réaction. Parconséquent, vous pouvez calculer le rendement de la réaction à partir de ce résultat théorique.
Rendement, % = (m(théorie)*100)/m(pratique),
Rendement (MH) = (100 g * 100) / 137,56 = 72,7 %.
Rendement (MH) = (100 g * 100) / 137,56 = 72,7 %.
Comme vous pouvez le constater, le rendement réel de 72,7 % est vraiment différent du rendement de 100 %, qui a été calculé par erreur à partir de la masse de réaction. Il joueun rôle important dans la production de toute substance.
Last edited:
