@G.Patton Je crois que l'un des intermédiaires dessinés dans cette synthèse (et dans l'article original sur le rhodium) est incorrect.
(3), la représentation de l'intermédiaire amphétamine-formaldéhyde imine possède la même structure que l'imine phénylacétone-méthylamine que l'on peut voir ailleurs.
cela ne me semble pas correct pour deux raisons : premièrement, le mécanisme standard de formation d'imine sur le substrat produit une imine dans laquelle la double liaison se situe entre N et le groupe méthyle potentiel de la méthamphétamine, et NON entre N et le carbone alpha comme dans la structure indiquée. et pensez-y : la double liaison est générée lorsque la paire solitaire de l'amine élimine l'eau formée sur l'oxygène du formaldéhyde en tant que groupe partant, ce qui doit être fait du côté du formaldéhyde (le groupe méthyle potentiel).
Deuxièmement, la synthèse est indiquée comme étant stéréospécifique sur la base du substrat de départ, c'est-à-dire que la réduction du d-amph produira du d-méth et la même chose pour l'isomère l. La structure telle qu'elle est représentée (3) ne possède pas de centre chiral et sa réduction est équivalente à l'amination réductrice standard de la phénylacétone qui produit un produit racémique. La structure proposée que j'ai donnée pour l'intermédiaire possède un centre chiral, qui serait le même que celui du produit de départ et correspondrait donc à la stéréospécificité observée de la réaction.
si j'ai raison, cela clarifierait les questions concernant la stéréospécificité de la réaction plus tôt dans le fil. si j'ai fait une erreur quelque part, je m'en excuse, mais j'étais curieux de savoir pourquoi la réduction du (3) non chiral conduit à un mélange non racémique de produits lorsqu'un matériau de départ d'amphétamine non racémique est utilisé.
(3), la représentation de l'intermédiaire amphétamine-formaldéhyde imine possède la même structure que l'imine phénylacétone-méthylamine que l'on peut voir ailleurs.
cela ne me semble pas correct pour deux raisons : premièrement, le mécanisme standard de formation d'imine sur le substrat produit une imine dans laquelle la double liaison se situe entre N et le groupe méthyle potentiel de la méthamphétamine, et NON entre N et le carbone alpha comme dans la structure indiquée. et pensez-y : la double liaison est générée lorsque la paire solitaire de l'amine élimine l'eau formée sur l'oxygène du formaldéhyde en tant que groupe partant, ce qui doit être fait du côté du formaldéhyde (le groupe méthyle potentiel).
Deuxièmement, la synthèse est indiquée comme étant stéréospécifique sur la base du substrat de départ, c'est-à-dire que la réduction du d-amph produira du d-méth et la même chose pour l'isomère l. La structure telle qu'elle est représentée (3) ne possède pas de centre chiral et sa réduction est équivalente à l'amination réductrice standard de la phénylacétone qui produit un produit racémique. La structure proposée que j'ai donnée pour l'intermédiaire possède un centre chiral, qui serait le même que celui du produit de départ et correspondrait donc à la stéréospécificité observée de la réaction.
si j'ai raison, cela clarifierait les questions concernant la stéréospécificité de la réaction plus tôt dans le fil. si j'ai fait une erreur quelque part, je m'en excuse, mais j'étais curieux de savoir pourquoi la réduction du (3) non chiral conduit à un mélange non racémique de produits lorsqu'un matériau de départ d'amphétamine non racémique est utilisé.
Tout d'abord, le carbone a a une plus grande densité d'électrons que le carbone méthyle. Le mécanisme typique conduisant à un tel intermédiaire (caché sous le filigrane de Breaking Bad, désolé) :
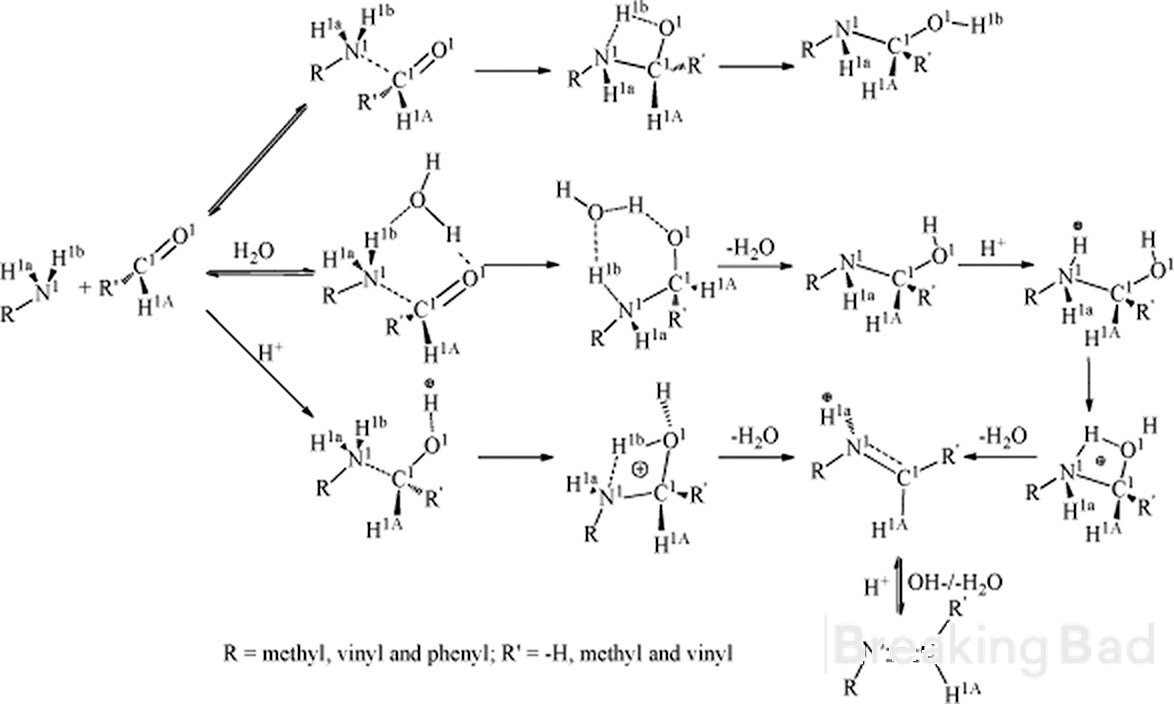
Deuxièmement, avez-vous des données fiables sur le résultat stéréo-spécifique de cette synthèse ?
Deuxièmement, avez-vous des données fiables sur le résultat stéréo-spécifique de cette synthèse ?
↑View previous replies…
- By NexusPrime
rhodium est une erreur, la double liaison n'existe pas, voir l'exemple avec le benzaldéhyde ci-dessous
