@G.Patton Úgy vélem, hogy az egyik rajzolt köztitermék ezen a szintézisen (és az eredeti ródium-cikkből) hibás.
(3), az amfetamin-formaldehid imin intermedier ábrázolása ugyanazzal a szerkezettel rendelkezik, mint a máshol látható fenilaceton-metilamin iminé.
ez számomra két okból sem tűnik helyesnek: először is, a szubsztráton történő iminképződés standard mechanizmusának megrajzolása olyan imint eredményez, amelyben a kettős kötés az N és a metamfetaminon lévő leendő metilcsoport között van, és NEM az N és az alfa-szén között, mint a felsorolt szerkezetben. és gondoljunk csak bele: a kettős kötés akkor jön létre, amikor az amin magányos párja a formaldehid oxigénjén képződött vizet mint távozó csoportot lerúgja, aminek a formaldehid (a leendő metilcsoport) oldalán kell megtörténnie.
másodszor, a szintézis a kiindulási szubsztrát alapján sztereospecifikusnak van jelentve. vagyis a d-amf redukciója d-met-et ad, és ugyanez az l-izomer esetében is. az ábrán látható szerkezet (3) nem rendelkezik királis centrummal, és redukciója egyenértékű a fenilaceton standard reduktív aminálásával, amely racém terméket ad. az általam megadott köztes termék javasolt szerkezete rendelkezik királis centrummal, amely megegyezik a kiindulási anyagéval, és így megfelel a reakció megfigyelt sztereospecifikus voltának.
Ha igazam van, akkor ez tisztázza a reakció sztereospecifikusságával kapcsolatos kérdéseket a téma korábbi részében. ha valahol hibáztam, akkor elnézést kérek, de kíváncsi voltam, hogy a nem királis (3) redukciója miért vezet nem racém termékkeverékhez, ha nem racém amfetamin kiindulási anyagot használunk.
(3), az amfetamin-formaldehid imin intermedier ábrázolása ugyanazzal a szerkezettel rendelkezik, mint a máshol látható fenilaceton-metilamin iminé.
ez számomra két okból sem tűnik helyesnek: először is, a szubsztráton történő iminképződés standard mechanizmusának megrajzolása olyan imint eredményez, amelyben a kettős kötés az N és a metamfetaminon lévő leendő metilcsoport között van, és NEM az N és az alfa-szén között, mint a felsorolt szerkezetben. és gondoljunk csak bele: a kettős kötés akkor jön létre, amikor az amin magányos párja a formaldehid oxigénjén képződött vizet mint távozó csoportot lerúgja, aminek a formaldehid (a leendő metilcsoport) oldalán kell megtörténnie.
másodszor, a szintézis a kiindulási szubsztrát alapján sztereospecifikusnak van jelentve. vagyis a d-amf redukciója d-met-et ad, és ugyanez az l-izomer esetében is. az ábrán látható szerkezet (3) nem rendelkezik királis centrummal, és redukciója egyenértékű a fenilaceton standard reduktív aminálásával, amely racém terméket ad. az általam megadott köztes termék javasolt szerkezete rendelkezik királis centrummal, amely megegyezik a kiindulási anyagéval, és így megfelel a reakció megfigyelt sztereospecifikus voltának.
Ha igazam van, akkor ez tisztázza a reakció sztereospecifikusságával kapcsolatos kérdéseket a téma korábbi részében. ha valahol hibáztam, akkor elnézést kérek, de kíváncsi voltam, hogy a nem királis (3) redukciója miért vezet nem racém termékkeverékhez, ha nem racém amfetamin kiindulási anyagot használunk.
G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 3,259
- Solutions
- 3
- Reaction score
- 3,718
- Points
- 113
- Deals
- 1
Szia. Először is, az a-szénnek nagyobb az elektronsűrűsége, mint a metilszénnek. Tipikus mechanizmus vezet ilyen köztes (Breaking Bad vízjel alá rejtett, sry):
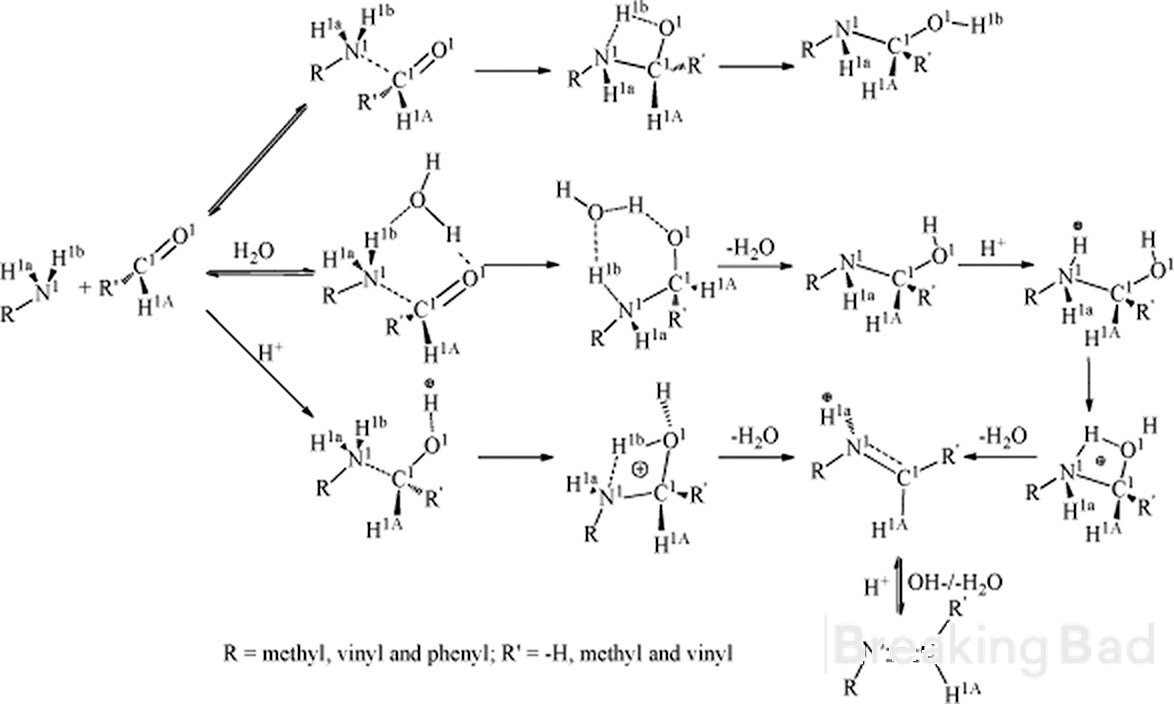
Másodszor, van megbízható adatod a szintézis sztereospecifikus eredményéről?
Másodszor, van megbízható adatod a szintézis sztereospecifikus eredményéről?
↑View previous replies…
- Language
- 🇷🇺
- Joined
- Apr 2, 2024
- Messages
- 3
- Reaction score
- 0
- Points
- 1
- By NexusPrime
a ródium hibás, a kettős kötés nincs ott, lásd az alábbi példát a benzaldehiddel kapcsolatban
