- Joined
- Dec 27, 2022
- Messages
- 30
- Reaction score
- 81
- Points
- 18
W porządku! Czas podzielić się z wami wiedzą. Opiszę syntezę psylocyny, którą przeprowadziłem, wraz ze zdjęciami. Wykorzystałem wytworzoną psylocynę i opracowałem prosty plaster samoprzylepny. Aby przetestować przenikanie psylocyny w plastrze, wykorzystaliśmy aparat dyfuzyjny, który złożyłem razem. Obejmuje on kilka membran, z plastrem o powierzchni 1 cm^2 umieszczonym na kawałku świeżej ludzkiej skóry o grubości 1 cm^2 i grubości 400 um (przekazanym przez centrum chirurgii brzucha). Pod skórą znajduje się stały przepływ wody o pH 7,4 i temperaturze ciała. Aparat dyfuzyjny jest w stanie zebrać frakcję 1 ml na godzinę, która jest następnie analizowana za pomocą LC-MS. Ilość psylocyny w fiolce 1 ml daje strumień (mg/hr/cm^2). To dyktuje, ile psylocyny przechodzi na godzinę przy rozmiarze plastra cm^2.
To staje się głębsze, ponieważ psylocyna jest wysoce niestabilna. Poniższa publikacja, Structure Elucidation and Spectroscopic Analysis of Chromophores Produced by Oxidative Psilocin Dimerization, omawia tę kwestię. Kiedy tworzy się dimer, jest on niewykrywalny za pomocą analizy HPLC i ATR-FTIR, co jest dziwne. Daje to grupom badawczym fałszywie pozytywne wyniki dotyczące czystości psylocyny. Znalazłem sposób na stabilizację psylocyny w plastrze.
W każdym razie, zaczynajmy! Każdy krok wykonałem sam, z pomocą mojego partnera, który jest inżynierem chemii. Było to w czasach, gdy miałem licencję DEA harmonogramu 1 i 3 nie tylko na badania, ale także na produkcję.
Część I (Synteza psylocyny)
krok 1: synteza octanu 3-[2-(dimetyloamino)-2-oksoacetylo]-1H-indol-4-ylu
1a. Kolbę okrągłodenną o pojemności 2000 ml z czterema szyjkami wyposażono w mieszadło górne, regulator temperatury J-Kem, lejek wkraplający o pojemności 250 ml i gumową przegrodę, przez którą wprowadzono podciśnienie suchego N2. Usunięto przegrodę i kolbę napełniono równomolowo octanem 1H-indol-4-ylu (5; 50,1 g, 285 mmol, 1 equiv)
i bezwodnym Et2O (700 ml). Kolbę ponownie zamknięto przegrodą i przepłukano N2. Zawiesinę mieszano przez 10 minut, a następnie
schłodzono do 0 °C w łaźni wodnej z lodem przez 30 min.

1b. Do lejka wkraplającego dodano roztwór chlorku oksalilu (37,1 ml, 428 mmol, 1,5 ekwiwalentu) w Et2O (60 ml). Roztwór chlorku oksalilu dodawano kroplami z szybkością wystarczającą do utrzymania temperatury na poziomie lub poniżej 5°C, aby zminimalizować tworzenie się dimeru i innych możliwych produktów ubocznych. W miarę postępu dodawania tworzyła się żółta zawiesina 10, a po zakończeniu dodawania mieszaninę mieszano przez 4 godziny.

1c. Po tym czasie dodano heptan (400 ml) i mieszaninę mieszano przez 30 minut w temperaturze 0°C. Otrzymane żółte ciało stałe szybko przefiltrowano i przepłukano kolejno heptanem (2 × 300 ml), który szybko wykorzystano w kolejnym etapie. . 2,0 M roztwór dimetyloaminy w THF (175 mL) dodawano kroplami z szybkością wystarczającą do utrzymania temperatury poniżej 5 °C w celu zminimalizowania reakcji ubocznych. Po
dodawano kroplami pirydynę (46 mL) w THF (100 mL) i mieszaninę dobrze mieszano przez 60 min. Dodano heptan (600 mL) i zawartość kolby przefiltrowano przez lejek Büchnera. Przefiltrowaną pozostałość przeniesiono do kolby okrągłodennej i dodano dejonizowaną H2O (1000 ml), mieszano przez 30 minut i przefiltrowano przez lejek Büchnera. Białawą substancję stałą poddano tritracji kolejno przez 40 minut w EtOAc (600 ml) i heptanie (400 ml). Zawiesinę przefiltrowano przez lejek Büchnera, a ciało stałe wysuszono w piecu w temperaturze 40 ° C przez noc, aby uzyskać 6 jako jasnożółte ciało stałe; wydajność: 66,1 g (81%); mp 205-207 ° C.



ATR-FTIR potwierdził syntezę octanu 3-[2-(dimetyloamino)-2-oksoacetylo]-1H-indol-4-ylu. Związek ten może być przechowywany w temperaturze 4C przez kilka miesięcy!
Krok 2: Synteza psylocyny
Etap 2A: Kolbę okrągłodenną o pojemności 2000 ml z czterema szyjkami wyposażono w mieszadło górne, regulator temperatury J-Kem, lejek wkraplający o pojemności 250 ml oraz wkraplacz o pojemności 250 ml.
250 ml lejek wkraplający i gumową przegrodę, przez którą wprowadzono nadciśnienie suchego N2. Przegroda została usunięta, a kolba
3-[2-(dimetyloamino)-2-oksoacetylo]-1H-indolo-4-ylooctanem (6; 31,5 g, 115 mmol) i 2-CH3-THF (1000 mL).
mL). Kolbę zanurzono w łaźni lodowej o temperaturze 0°C i dodano roztwór 2,3 M LiAlH4 w 2-CH3-THF (140 mL, 322 mmol) przez lejek wkraplający o objętości 250 mL.
lejek wkraplający o pojemności 250 ml. Lej wkraplający przepłukano dodatkowym 2-CH3-THF (20 mL). Roztwór LiAlH4 dodawano kroplami
z szybkością pozwalającą na utrzymanie temperatury poniżej 20°C. Po dodaniu, usunięto lodowatą łaźnię wodną i mieszano mieszaninę przez 30 min.
Jasnożółty roztwór ogrzano do temperatury wrzenia (80 °C) za pomocą płaszcza grzejnego i po 3 h uzyskał on barwę kości słoniowej.
żółtych ciał stałych zaobserwowano po bokach kolby okrągłodennej



Krok 2C. Usunięto płaszcz grzewczy i pozostawiono kolbę do ostygnięcia do temperatury 50°C. Kolba została ponownie
schłodzono do 20 °C. Reakcję wygaszono dodając kolejno 3 krople aq 1 M NaOH i 3 krople dejonizowanej H2O. Mieszaninę
rozcieńczono THF (500 ml) i mieszano przez 20 min. Mieszaninę przefiltrowano przez lejek Büchnera, a filtrat utrzymywano pod N2.
Placek filtracyjny szybko przemyto ponownie 200 ml [10% roztworu (7% amoniaku w MeOH) w CH2Cl2] i THF (500 ml). Filtraty
następnie połączono i zatężono, otrzymując zieloną substancję stałą. Ciało stałe rozcierano w stosunku 1:1 EtOAc/heptan (50 mL), a następnie przefiltrowano przez lejek Büchnera.
lejek Büchnera. Ciemnozielone ciało stałe suszono w piecu w temperaturze 40°C przez noc, otrzymując suchą psylocynę (7) w postaci ciemnozielonego ciała stałego; wydajność: 20,7 g (91%); mp.
g (91%); mp 167-169 °C.
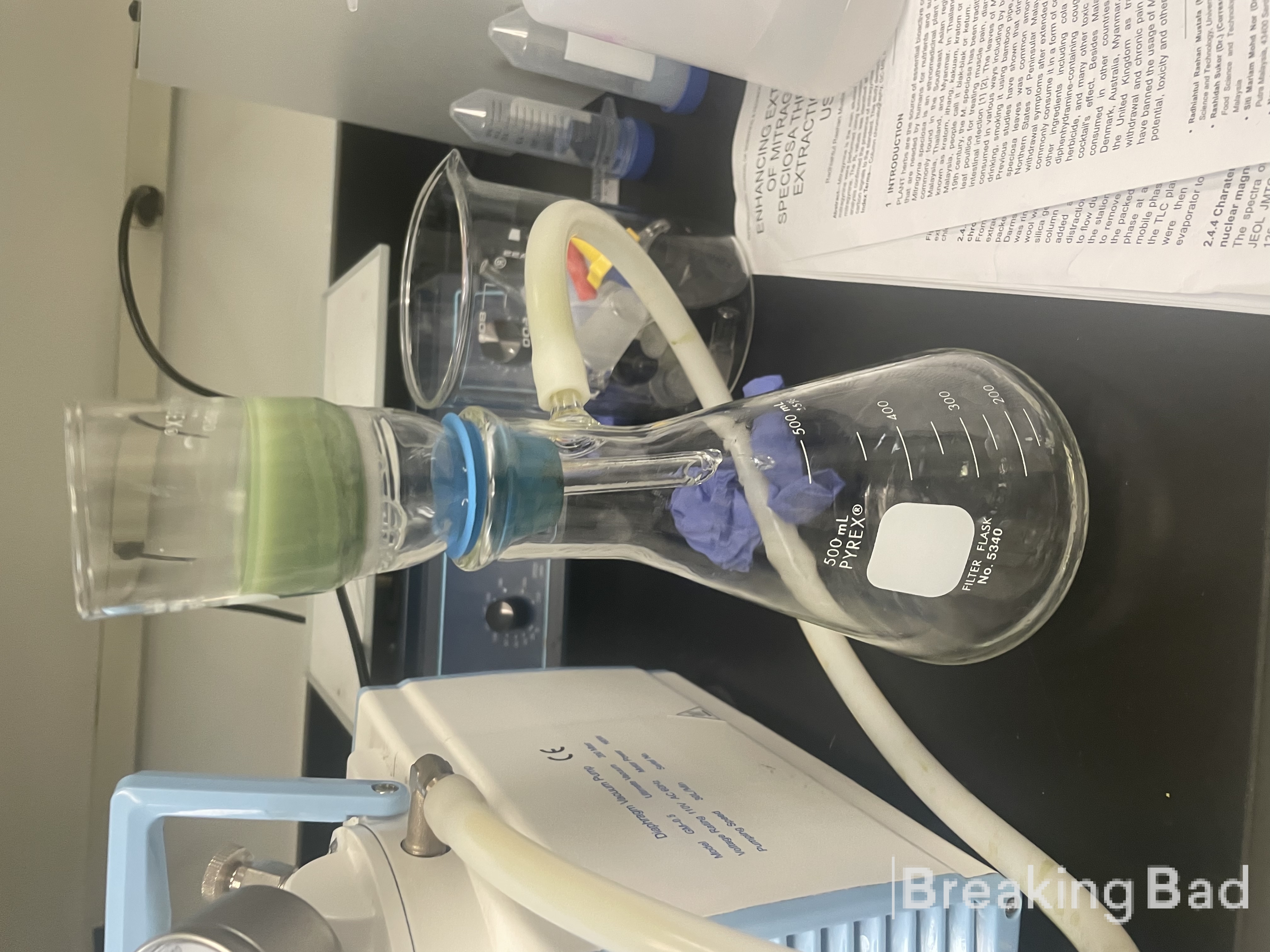


Psylocyna została zsyntetyzowana.
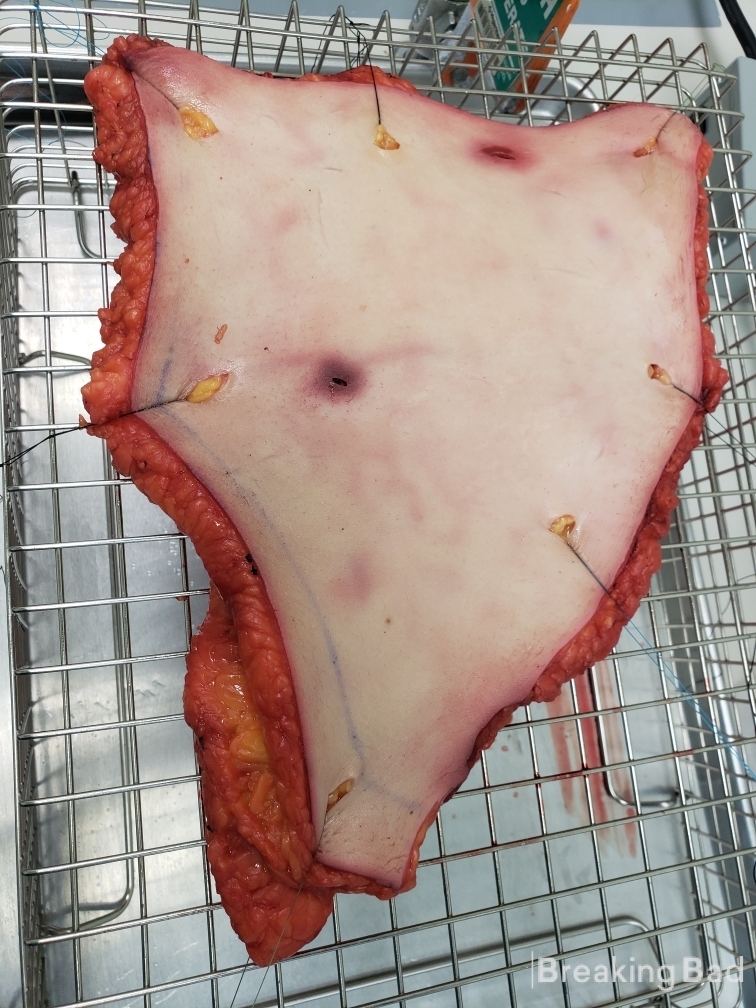
Część II: Opracowanie przezskórnego plastra psylocynowego i badanie in vitro (UWAGA: WIDZISZ ŚWIEŻĄ LUDZKĄ FLESZĘ, JEST BRUTALNA).
Następnie rozpuszczam psylocynę w zastrzeżonej mieszance polimeru akrylanowego (w heptanie), a następnie wlewam roztwór do linii uwalniania i używam noża do odlewania, aby uzyskać warstwę kleju do 100 um. Po wyschnięciu nakładam warstwę podkładową i wycinam plaster o powierzchni 1 cm^2. Ten plaster jest używany do badania in vitro.
Poniższe zdjęcie jest migawką aparatu dyfuzyjnego (plaster na wierzchu skóry z wodą płynącą poniżej).

Mam nadzieję, że się podobało!
To staje się głębsze, ponieważ psylocyna jest wysoce niestabilna. Poniższa publikacja, Structure Elucidation and Spectroscopic Analysis of Chromophores Produced by Oxidative Psilocin Dimerization, omawia tę kwestię. Kiedy tworzy się dimer, jest on niewykrywalny za pomocą analizy HPLC i ATR-FTIR, co jest dziwne. Daje to grupom badawczym fałszywie pozytywne wyniki dotyczące czystości psylocyny. Znalazłem sposób na stabilizację psylocyny w plastrze.
W każdym razie, zaczynajmy! Każdy krok wykonałem sam, z pomocą mojego partnera, który jest inżynierem chemii. Było to w czasach, gdy miałem licencję DEA harmonogramu 1 i 3 nie tylko na badania, ale także na produkcję.
Część I (Synteza psylocyny)
krok 1: synteza octanu 3-[2-(dimetyloamino)-2-oksoacetylo]-1H-indol-4-ylu
1a. Kolbę okrągłodenną o pojemności 2000 ml z czterema szyjkami wyposażono w mieszadło górne, regulator temperatury J-Kem, lejek wkraplający o pojemności 250 ml i gumową przegrodę, przez którą wprowadzono podciśnienie suchego N2. Usunięto przegrodę i kolbę napełniono równomolowo octanem 1H-indol-4-ylu (5; 50,1 g, 285 mmol, 1 equiv)
i bezwodnym Et2O (700 ml). Kolbę ponownie zamknięto przegrodą i przepłukano N2. Zawiesinę mieszano przez 10 minut, a następnie
schłodzono do 0 °C w łaźni wodnej z lodem przez 30 min.
1b. Do lejka wkraplającego dodano roztwór chlorku oksalilu (37,1 ml, 428 mmol, 1,5 ekwiwalentu) w Et2O (60 ml). Roztwór chlorku oksalilu dodawano kroplami z szybkością wystarczającą do utrzymania temperatury na poziomie lub poniżej 5°C, aby zminimalizować tworzenie się dimeru i innych możliwych produktów ubocznych. W miarę postępu dodawania tworzyła się żółta zawiesina 10, a po zakończeniu dodawania mieszaninę mieszano przez 4 godziny.
1c. Po tym czasie dodano heptan (400 ml) i mieszaninę mieszano przez 30 minut w temperaturze 0°C. Otrzymane żółte ciało stałe szybko przefiltrowano i przepłukano kolejno heptanem (2 × 300 ml), który szybko wykorzystano w kolejnym etapie. . 2,0 M roztwór dimetyloaminy w THF (175 mL) dodawano kroplami z szybkością wystarczającą do utrzymania temperatury poniżej 5 °C w celu zminimalizowania reakcji ubocznych. Po
dodawano kroplami pirydynę (46 mL) w THF (100 mL) i mieszaninę dobrze mieszano przez 60 min. Dodano heptan (600 mL) i zawartość kolby przefiltrowano przez lejek Büchnera. Przefiltrowaną pozostałość przeniesiono do kolby okrągłodennej i dodano dejonizowaną H2O (1000 ml), mieszano przez 30 minut i przefiltrowano przez lejek Büchnera. Białawą substancję stałą poddano tritracji kolejno przez 40 minut w EtOAc (600 ml) i heptanie (400 ml). Zawiesinę przefiltrowano przez lejek Büchnera, a ciało stałe wysuszono w piecu w temperaturze 40 ° C przez noc, aby uzyskać 6 jako jasnożółte ciało stałe; wydajność: 66,1 g (81%); mp 205-207 ° C.
ATR-FTIR potwierdził syntezę octanu 3-[2-(dimetyloamino)-2-oksoacetylo]-1H-indol-4-ylu. Związek ten może być przechowywany w temperaturze 4C przez kilka miesięcy!
Krok 2: Synteza psylocyny
Etap 2A: Kolbę okrągłodenną o pojemności 2000 ml z czterema szyjkami wyposażono w mieszadło górne, regulator temperatury J-Kem, lejek wkraplający o pojemności 250 ml oraz wkraplacz o pojemności 250 ml.
250 ml lejek wkraplający i gumową przegrodę, przez którą wprowadzono nadciśnienie suchego N2. Przegroda została usunięta, a kolba
3-[2-(dimetyloamino)-2-oksoacetylo]-1H-indolo-4-ylooctanem (6; 31,5 g, 115 mmol) i 2-CH3-THF (1000 mL).
mL). Kolbę zanurzono w łaźni lodowej o temperaturze 0°C i dodano roztwór 2,3 M LiAlH4 w 2-CH3-THF (140 mL, 322 mmol) przez lejek wkraplający o objętości 250 mL.
lejek wkraplający o pojemności 250 ml. Lej wkraplający przepłukano dodatkowym 2-CH3-THF (20 mL). Roztwór LiAlH4 dodawano kroplami
z szybkością pozwalającą na utrzymanie temperatury poniżej 20°C. Po dodaniu, usunięto lodowatą łaźnię wodną i mieszano mieszaninę przez 30 min.
Jasnożółty roztwór ogrzano do temperatury wrzenia (80 °C) za pomocą płaszcza grzejnego i po 3 h uzyskał on barwę kości słoniowej.
żółtych ciał stałych zaobserwowano po bokach kolby okrągłodennej
Krok 2C. Usunięto płaszcz grzewczy i pozostawiono kolbę do ostygnięcia do temperatury 50°C. Kolba została ponownie
schłodzono do 20 °C. Reakcję wygaszono dodając kolejno 3 krople aq 1 M NaOH i 3 krople dejonizowanej H2O. Mieszaninę
rozcieńczono THF (500 ml) i mieszano przez 20 min. Mieszaninę przefiltrowano przez lejek Büchnera, a filtrat utrzymywano pod N2.
Placek filtracyjny szybko przemyto ponownie 200 ml [10% roztworu (7% amoniaku w MeOH) w CH2Cl2] i THF (500 ml). Filtraty
następnie połączono i zatężono, otrzymując zieloną substancję stałą. Ciało stałe rozcierano w stosunku 1:1 EtOAc/heptan (50 mL), a następnie przefiltrowano przez lejek Büchnera.
lejek Büchnera. Ciemnozielone ciało stałe suszono w piecu w temperaturze 40°C przez noc, otrzymując suchą psylocynę (7) w postaci ciemnozielonego ciała stałego; wydajność: 20,7 g (91%); mp.
g (91%); mp 167-169 °C.
Psylocyna została zsyntetyzowana.
Część II: Opracowanie przezskórnego plastra psylocynowego i badanie in vitro (UWAGA: WIDZISZ ŚWIEŻĄ LUDZKĄ FLESZĘ, JEST BRUTALNA).
Następnie rozpuszczam psylocynę w zastrzeżonej mieszance polimeru akrylanowego (w heptanie), a następnie wlewam roztwór do linii uwalniania i używam noża do odlewania, aby uzyskać warstwę kleju do 100 um. Po wyschnięciu nakładam warstwę podkładową i wycinam plaster o powierzchni 1 cm^2. Ten plaster jest używany do badania in vitro.
Poniższe zdjęcie jest migawką aparatu dyfuzyjnego (plaster na wierzchu skóry z wodą płynącą poniżej).
Mam nadzieję, że się podobało!


