Brain
Expert Pharmacologist
- Joined
- Jul 6, 2021
- Messages
- 311
- Reaction score
- 332
- Points
- 63
O desejo compulsivo de comer, comer e comer de novo depois de consumir maconha, mesmo que o estômago não concorde com isso, é tanto uma maldição quanto uma salvação. Tudo depende do objetivo do uso dessa planta. E o mecanismo recém-descoberto da ação dos canabinoides no cérebro acabou sendo paradoxal: o apetite indomável é causado pela estimulação dos neurônios hipotalâmicos que normalmente formam a sensação de saciedade. Aqui, também, os "invasores bacterianos" - as mitocôndrias - estavam envolvidos.
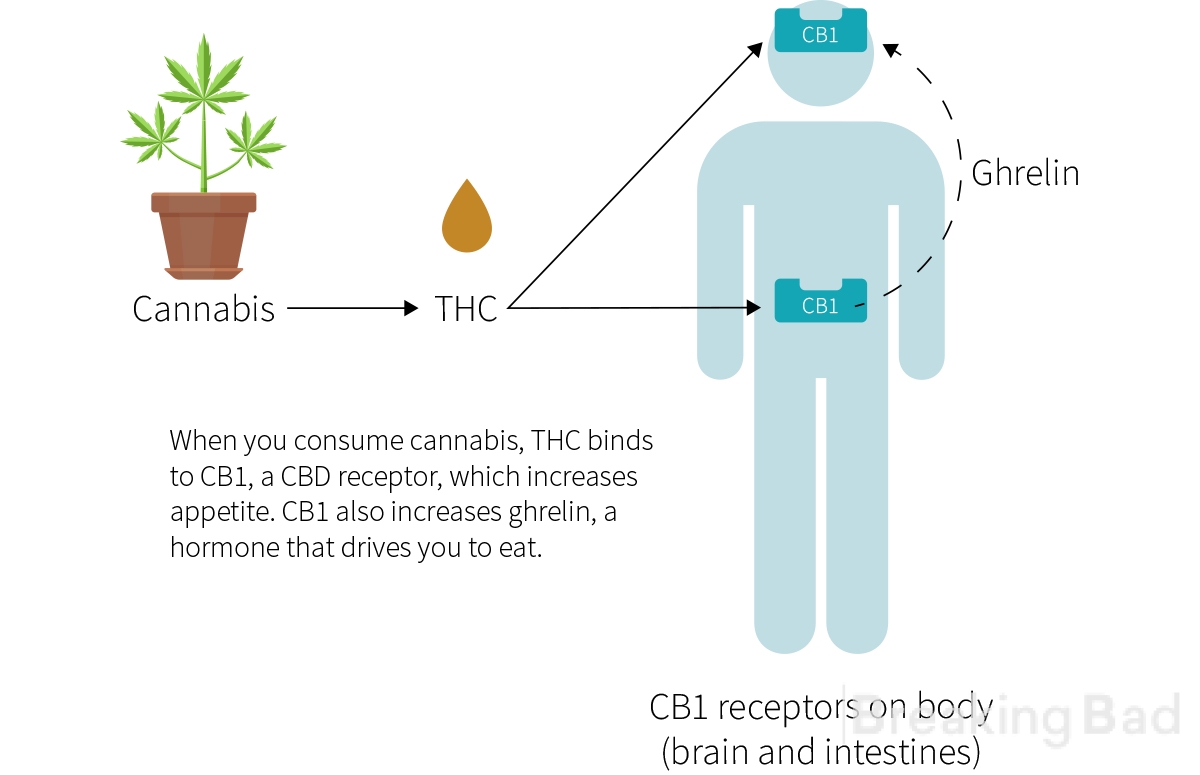

Esse efeito da cannabis, popularmente descrito como "a larica", é bem conhecido e é até mesmo usado na medicina para aumentar o apetite de pacientes que sofrem de perda de peso devido à anorexia dolorosa ou a um tratamento de câncer particularmente tóxico. As substâncias psicoativas da cannabis, os canabinoides, causam esse efeito. A mais ativa e estudada delas é o terpenoide delta-9-tetrahidrocanabinol, ou THC. É esse canabinoide - sintetizado sob o nome genérico dronabinol - que é aprovado para uso médico nos Estados Unidos, no Canadá e em alguns países europeus. Como suas vantagens em relação a outros antieméticos e analgésicos são questionáveis, o dronabinol é prescrito apenas em casos de intolerância à terapia padrão.
Em 2015, pesquisadores da Universidade de Yale (EUA), liderados por Tamas Horvath, descobriram o paradoxo desses mecanismos: o apetite é despertado pela ativação de circuitos cerebrais, cuja função normal é criar a sensação de saciedade, mas não a fome incontrolável. No entanto, o paradoxo acabou sendo apenas externo: um estudo realizado em uma linhagem especial de camundongos geneticamente modificados esclareceu o "hackeamento" do sistema de sensação de saciedade. Isso foi explicado por um modo complexo de operação de um grupo especial de neurônios hipotalâmicos que produzem proopiomelanocortina, um precursor de vários hormônios, incluindo o hormônio adrenocorticotrópico, hormônios estimuladores de melanócitos e o opioide endógeno β-endorfina.
Em 2015, pesquisadores da Universidade de Yale (EUA), liderados por Tamas Horvath, descobriram o paradoxo desses mecanismos: o apetite é despertado pela ativação de circuitos cerebrais, cuja função normal é criar a sensação de saciedade, mas não a fome incontrolável. No entanto, o paradoxo acabou sendo apenas externo: um estudo realizado em uma linhagem especial de camundongos geneticamente modificados esclareceu o "hackeamento" do sistema de sensação de saciedade. Isso foi explicado por um modo complexo de operação de um grupo especial de neurônios hipotalâmicos que produzem proopiomelanocortina, um precursor de vários hormônios, incluindo o hormônio adrenocorticotrópico, hormônios estimuladores de melanócitos e o opioide endógeno β-endorfina.
O elo central na regulação do apetite
A regulação central do apetite é realizada pelas vias de sinalização hipotalâmicas, predominantemente do núcleo arqueado. O hipotálamo, devido à ausência local da barreira hematoencefálica, integra os sinais hormonais do sistema digestivo, do tecido adiposo e do sistema de recompensa do cérebro e, de acordo com eles, gera "comandos" que enfraquecem ou aumentam o metabolismo, a motilidade intestinal e o apetite. As células do núcleo arqueado transmitem sinais aos neurônios de ordem II em outras partes do hipotálamo, especialmente no núcleo paraventricular, onde são produzidos os hormônios que regulam a atividade do sistema nervoso simpático e a função das glândulas tireoide e adrenal.
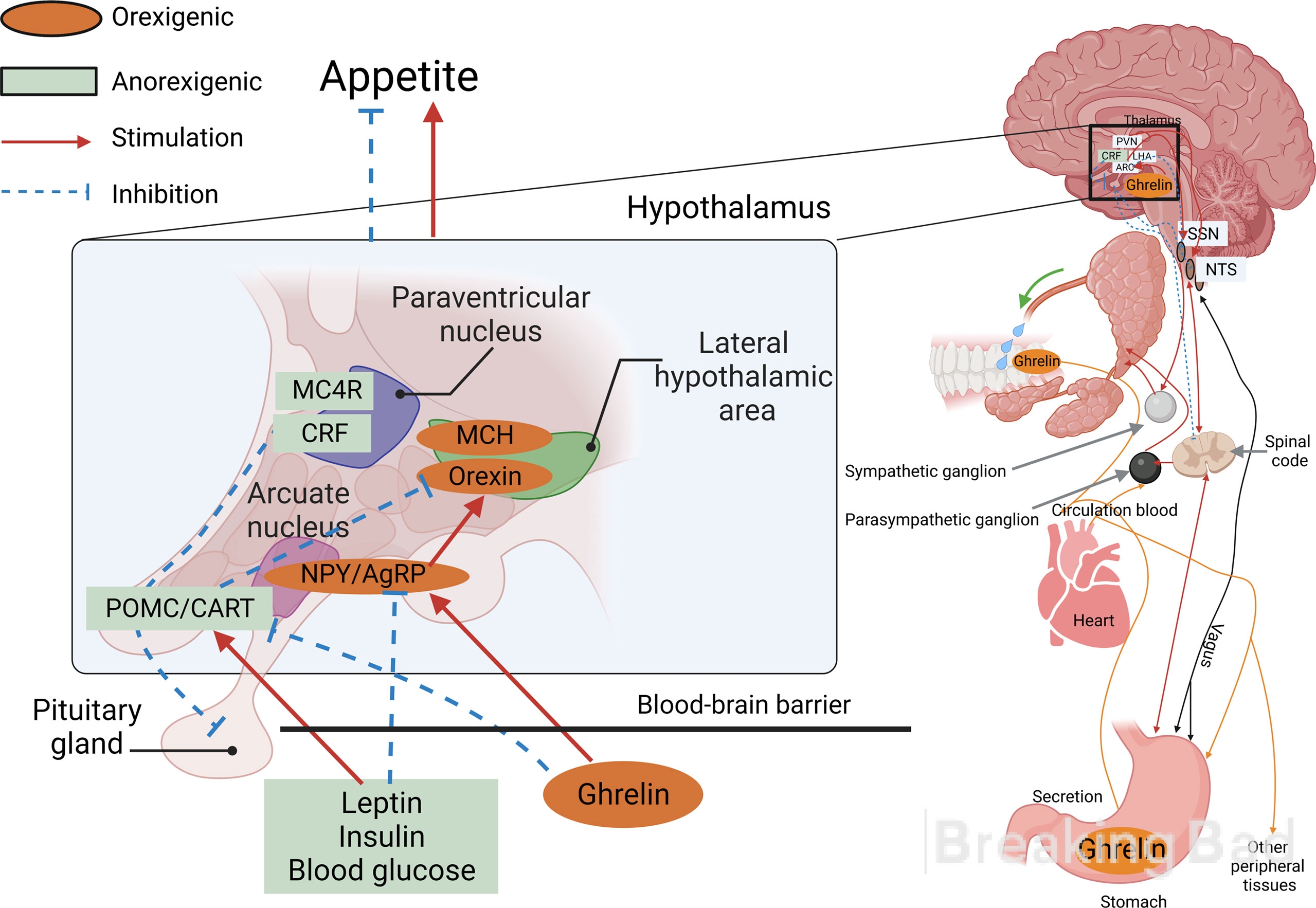
Dentro do núcleo em forma de arco do hipotálamo há duas populações de neurônios que agem em direções diferentes e, assim, mantêm o equilíbrio energético do corpo (a imagem mostra o mecanismo molecular de manutenção desse equilíbrio e da regulação do apetite).
A imagem mostra o mecanismo molecular de manutenção desse equilíbrio e da regulação do apetite. Dentro do núcleo em forma de arco do hipotálamo há duas populações de neurônios que atuam em direções diferentes e, assim, mantêm o equilíbrio energético do corpo .
A regulação central do apetite é realizada pelas vias de sinalização hipotalâmicas, predominantemente do núcleo arqueado. O hipotálamo, devido à ausência local da barreira hematoencefálica, integra os sinais hormonais do sistema digestivo, do tecido adiposo e do sistema de recompensa do cérebro e, de acordo com eles, gera "comandos" que enfraquecem ou aumentam o metabolismo, a motilidade intestinal e o apetite. As células do núcleo arqueado transmitem sinais aos neurônios de ordem II em outras partes do hipotálamo, especialmente no núcleo paraventricular, onde são produzidos os hormônios que regulam a atividade do sistema nervoso simpático e a função das glândulas tireoide e adrenal.
Dentro do núcleo em forma de arco do hipotálamo há duas populações de neurônios que agem em direções diferentes e, assim, mantêm o equilíbrio energético do corpo (a imagem mostra o mecanismo molecular de manutenção desse equilíbrio e da regulação do apetite).
A imagem mostra o mecanismo molecular de manutenção desse equilíbrio e da regulação do apetite. Dentro do núcleo em forma de arco do hipotálamo há duas populações de neurônios que atuam em direções diferentes e, assim, mantêm o equilíbrio energético do corpo .
- Os neurônios que produzem peptídeos orexigênicos que estimulam o apetite e diminuem a taxa metabólica e o gasto de energia são a proteína semelhante à agouti e o neuropeptídeo Y (o peptídeo predominante do SNC).
- Os neurônios que produzem neuropeptídeos anorexígenos supressores do apetite são a proopiomelanocortina e o transcrito regulado pela cocaína-anfetamina. Pouco se sabe ainda sobre o transcrito regulado por cocaína-anfetamina. Ele parece ser um psicoestimulante endógeno, com efeito semelhante ao da anfetamina e da cocaína, e um alvo em potencial para a terapia da dependência. Mutações do gene CARTPT foram associadas a uma propensão ao alcoolismo. Acredita-se que o CARTPT desempenhe um papel fundamental na modulação da atividade da via da dopamina mesolímbica do sistema de recompensa do cérebro. Foidemonstrado que esse peptídeo reduz o apetite e a taxa de acúmulo de gordura, e uma diminuição em sua atividade no hipotálamo de animais (na depressão, por exemplo) leva à gula e à obesidade.
Ligação periférica na regulação do apetite
Acredita-se que os principais moduladores periféricos do comportamento alimentar sejam os hormônios insulina, leptina e grelina, que têm influência direcionada de forma diferente sobre a atividade dos neurônios hipotalâmicos.
Leptina - é secretada pelas células do tecido adiposo quando o alimento é ingerido, em proporção à quantidade de gordura no corpo, e reduz o apetite.
Insulina - é secretada pelas células β das ilhotas de Langerhans do pâncreas após uma refeição. A ação periférica da insulina é anabólica e anticatabólica: aumenta a síntese de gorduras e proteínas, aumenta a entrada de glicose nas células (diminuindo seu nível no sangue), estimula a formação de glicogênio a partir da glicose e inibe a quebra de glicogênio e gorduras. O efeito central da insulina, ao contrário, é catabólico - reduz o apetite, deslocando o equilíbrio energético para o lado do "gasto".
Tanto a leptina quanto a insulina interagem com ambas as populações neuronais: inibem as células NP-y/APB ourexigênicas e ativam as células POMC/CART condicionalmente anorexigênicas (veja a figura com o diagrama molecular). A leptina, além disso, reduz a saída do mediador inibitório GABA dos axônios em contato com os neurônios POMC. Tudo isso geralmente leva a um efeito anorexígeno - supressão do apetite.
As células GI sintetizam vários hormônios anorexígenos e apenas um peptídeo estimulador do apetite, a grelina (hormônio da fome). Ele é produzido pelas paredes do estômago e do intestino delgado durante a inanição e, no cérebro, interage com os receptores do hormônio do crescimento (GHSR1a) e estimula sua secreção, razão pela qual foi nomeado: indutor de liberação do hormônio do crescimento (grelina). No núcleo arqueado do hipotálamo, a grelina excita os neurônios NP-y/APB, levando as pessoas a comer, e também medeia o prazer do álcool e da comida deliciosa.
Pontos de aplicação de canabinoides nesse esquema
Como descobrimos, a consequência da estimulação dos neurônios POMC é a diminuição do apetite, e a dos neurônios APB é o aumento do apetite. Portanto, seria lógico explicar o fenômeno da "fome" após o uso da maconha pela inibição da primeira população de células e/ou ativação da segunda. No entanto, um estudo recente conduzido pelo grupo de Tamas Horvath descobriu que, na realidade, a cannabis age exatamente ao contrário: a fome em pessoas bem alimentadas é provocada pela ativação dos neurônios POMC, enquanto as células APB ficam "silenciosas".
Com base nas evidências coletadas, os autores do trabalho propuseram um esquema de excitação dos neurônios POMC por canabinoides, incluindo duas vias.
Acredita-se que os principais moduladores periféricos do comportamento alimentar sejam os hormônios insulina, leptina e grelina, que têm influência direcionada de forma diferente sobre a atividade dos neurônios hipotalâmicos.
Leptina - é secretada pelas células do tecido adiposo quando o alimento é ingerido, em proporção à quantidade de gordura no corpo, e reduz o apetite.
Insulina - é secretada pelas células β das ilhotas de Langerhans do pâncreas após uma refeição. A ação periférica da insulina é anabólica e anticatabólica: aumenta a síntese de gorduras e proteínas, aumenta a entrada de glicose nas células (diminuindo seu nível no sangue), estimula a formação de glicogênio a partir da glicose e inibe a quebra de glicogênio e gorduras. O efeito central da insulina, ao contrário, é catabólico - reduz o apetite, deslocando o equilíbrio energético para o lado do "gasto".
Tanto a leptina quanto a insulina interagem com ambas as populações neuronais: inibem as células NP-y/APB ourexigênicas e ativam as células POMC/CART condicionalmente anorexigênicas (veja a figura com o diagrama molecular). A leptina, além disso, reduz a saída do mediador inibitório GABA dos axônios em contato com os neurônios POMC. Tudo isso geralmente leva a um efeito anorexígeno - supressão do apetite.
As células GI sintetizam vários hormônios anorexígenos e apenas um peptídeo estimulador do apetite, a grelina (hormônio da fome). Ele é produzido pelas paredes do estômago e do intestino delgado durante a inanição e, no cérebro, interage com os receptores do hormônio do crescimento (GHSR1a) e estimula sua secreção, razão pela qual foi nomeado: indutor de liberação do hormônio do crescimento (grelina). No núcleo arqueado do hipotálamo, a grelina excita os neurônios NP-y/APB, levando as pessoas a comer, e também medeia o prazer do álcool e da comida deliciosa.
Pontos de aplicação de canabinoides nesse esquema
Como descobrimos, a consequência da estimulação dos neurônios POMC é a diminuição do apetite, e a dos neurônios APB é o aumento do apetite. Portanto, seria lógico explicar o fenômeno da "fome" após o uso da maconha pela inibição da primeira população de células e/ou ativação da segunda. No entanto, um estudo recente conduzido pelo grupo de Tamas Horvath descobriu que, na realidade, a cannabis age exatamente ao contrário: a fome em pessoas bem alimentadas é provocada pela ativação dos neurônios POMC, enquanto as células APB ficam "silenciosas".
Com base nas evidências coletadas, os autores do trabalho propuseram um esquema de excitação dos neurônios POMC por canabinoides, incluindo duas vias.
- Via pré-sináptica: Quando os canabinoides interagem com os receptores CB1R dos axônios que formam sinapses com os neurônios POMC, a liberação do neurotransmissor inibitório GABA dos neurônios pré-sinápticos (por exemplo, células APB) é bloqueada. Como resultado, os neurônios POMC podem ficar excitados.
- Via mitocondrial (nova e básica): quando os canabinoides interagem com os receptores CB1R dos neurônios POMC mitocondriais, a respiração mitocondrial é estimulada, as espécies reativas de oxigênio (ROS) são produzidas e a expressão da proteína de desacoplamento mitocondrial 2 (RB2, UCP2) aumenta. É essa proteína que está envolvida na regulação da produção de AFC e do comportamento alimentar.
Mas por que, nesse caso, as células secretam β-endorfina? O fato é que o α-MSH e a β-endorfina de ação oposta são codificados pelo mesmo gene Pomc, pois são formados por conversões pós-traducionais do mesmo peptídeo POMC. Os níveis de expressão gênica das duas conversões que realizam essa formação não diferem quando os canabinoides se ligam aos receptores CB1R.
Aparentemente, o α-MSH e a β-endorfina também são produzidos em quantidades iguais nesse caso, mas são secretados seletivamente pelos neurônios POMC. Tamas Horvath e seus colegas demonstraram que cerca de 35% dos brotos neuronais POMC que formam sinapses com neurônios do núcleo paraventricular contêm vesículas secretoras com α-MSH ou β-endorfina. Ou seja, esses peptídeos são produzidos de forma sincronizada e em quantidades iguais, mas são armazenados separadamente e, o que é mais importante, secretados pelos neurônios POMC sob o controle de diferentes sinais. A RB2, sob a influência dos canabinoides, "muda a seta" da via de secreção do α-MSH redutor do apetite para a via de secreção da β-endorfina, que causa o desfiladeiro irresistível (e possivelmente a obesidade).
Ainda não se sabe se o efeito descrito da PB2 é exclusivo da população de neurônios POMC, pois já foi demonstrado que essa proteína também é produzida por muitas outras células do sistema nervoso. Também não se sabe se os neurônios de outras regiões do cérebro respondem aos canabinoides exatamente da mesma forma. A equipe de Yale concentrou-se especificamente na alimentação descontrolada mediada por CB1R de animais saciados, que é exatamente o que os amantes de canabinoides fazem. É possível que os neurônios POMC hipotalâmicos também estejam envolvidos no desenvolvimento de outros sintomas associados ao uso da maconha.

Conclusão
Assim, paradoxalmente, os neurônios que normalmente induzem uma sensação de saciedade tornam-se a força motriz por trás do consumo de alimentos sob a influência do THC. A cannabis ativa o bulbo olfativo no cérebro (o departamento responsável pelo reconhecimento de odores), o que leva a um cheiro melhor e mais forte dos alimentos. O THC também atua em receptores em uma área do cérebro chamada núcleo adjacente, o que aumenta a liberação do neurotransmissor dopamina. A liberação de dopamina aumenta a sensação de prazer ao comer alto. O cérebro libera dopamina naturalmente quando ingerimos alimentos prazerosos, mas quando o THC está presente, o corpo recebe uma liberação adicional de dopamina do que você come.
O THC também interage com os receptores CB1 no hipotálamo para liberar um hormônio chamado grelina, um hormônio que estimula o apetite e acelera a digestão. OTHC não apenas estimula esse hormônio, mas a grelina também é responsável pela sensação de fome, que desempenha um papel no metabolismo dos carboidratos, o que os cientistas supõem ser o motivo pelo qual o THC faz você sentir fome e desejar substâncias ricas em carboidratos.
Aparentemente, o α-MSH e a β-endorfina também são produzidos em quantidades iguais nesse caso, mas são secretados seletivamente pelos neurônios POMC. Tamas Horvath e seus colegas demonstraram que cerca de 35% dos brotos neuronais POMC que formam sinapses com neurônios do núcleo paraventricular contêm vesículas secretoras com α-MSH ou β-endorfina. Ou seja, esses peptídeos são produzidos de forma sincronizada e em quantidades iguais, mas são armazenados separadamente e, o que é mais importante, secretados pelos neurônios POMC sob o controle de diferentes sinais. A RB2, sob a influência dos canabinoides, "muda a seta" da via de secreção do α-MSH redutor do apetite para a via de secreção da β-endorfina, que causa o desfiladeiro irresistível (e possivelmente a obesidade).
Ainda não se sabe se o efeito descrito da PB2 é exclusivo da população de neurônios POMC, pois já foi demonstrado que essa proteína também é produzida por muitas outras células do sistema nervoso. Também não se sabe se os neurônios de outras regiões do cérebro respondem aos canabinoides exatamente da mesma forma. A equipe de Yale concentrou-se especificamente na alimentação descontrolada mediada por CB1R de animais saciados, que é exatamente o que os amantes de canabinoides fazem. É possível que os neurônios POMC hipotalâmicos também estejam envolvidos no desenvolvimento de outros sintomas associados ao uso da maconha.
Conclusão
Assim, paradoxalmente, os neurônios que normalmente induzem uma sensação de saciedade tornam-se a força motriz por trás do consumo de alimentos sob a influência do THC. A cannabis ativa o bulbo olfativo no cérebro (o departamento responsável pelo reconhecimento de odores), o que leva a um cheiro melhor e mais forte dos alimentos. O THC também atua em receptores em uma área do cérebro chamada núcleo adjacente, o que aumenta a liberação do neurotransmissor dopamina. A liberação de dopamina aumenta a sensação de prazer ao comer alto. O cérebro libera dopamina naturalmente quando ingerimos alimentos prazerosos, mas quando o THC está presente, o corpo recebe uma liberação adicional de dopamina do que você come.
O THC também interage com os receptores CB1 no hipotálamo para liberar um hormônio chamado grelina, um hormônio que estimula o apetite e acelera a digestão. OTHC não apenas estimula esse hormônio, mas a grelina também é responsável pela sensação de fome, que desempenha um papel no metabolismo dos carboidratos, o que os cientistas supõem ser o motivo pelo qual o THC faz você sentir fome e desejar substâncias ricas em carboidratos.
