@G.Patton Cred că unul dintre intermediarii trași pe această sinteză (și din articolul original despre rodiu) este incorect.
(3), reprezentarea intermediarului imină amfetamină-formaldehidă posedă aceeași structură ca imina fenilacetonă-metilamină care poate fi văzută în altă parte
acest lucru nu mi se pare corect din două motive: în primul rând, desenarea mecanismului standard de formare a iminei pe substrat produce o imină în care dubla legătură este între N și presupusa grupare metil de pe metamfetamină, și NU între N și carbonul alfa, ca în structura prezentată. și gândiți-vă: dubla legătură este generată atunci când perechea singuratică a aminei elimină apa formată pe oxigenul formaldehidei ca grupare care pleacă, ceea ce trebuie să se facă pe partea formaldehidei (presupusa grupare metil)
în al doilea rând, sinteza este raportată ca fiind stereospecifică pe baza substratului de plecare. adică, reducerea d-amf va produce d-meth și același lucru pentru izomerul l. structura așa cum este prezentată (3) nu posedă centre chirale, iar reducerea sa este echivalentă cu aminarea reductivă standard a fenilacetonei care produce un produs racemic. structura propusă pe care am dat-o pentru intermediar posedă un centru chiral, care ar fi același cu cel al materialului de plecare și, prin urmare, corespunde stereospecificității observate a reacției.
dacă am dreptate, acest lucru ar clarifica problemele legate de stereospecificitatea reacției de mai devreme. dacă am făcut o greșeală undeva, îmi cer scuze, dar eram curios de ce reducerea non-chiralului (3) duce la un amestec non-racemic de produse atunci când se utilizează un material de plecare amfetaminic non-racemic.
(3), reprezentarea intermediarului imină amfetamină-formaldehidă posedă aceeași structură ca imina fenilacetonă-metilamină care poate fi văzută în altă parte
acest lucru nu mi se pare corect din două motive: în primul rând, desenarea mecanismului standard de formare a iminei pe substrat produce o imină în care dubla legătură este între N și presupusa grupare metil de pe metamfetamină, și NU între N și carbonul alfa, ca în structura prezentată. și gândiți-vă: dubla legătură este generată atunci când perechea singuratică a aminei elimină apa formată pe oxigenul formaldehidei ca grupare care pleacă, ceea ce trebuie să se facă pe partea formaldehidei (presupusa grupare metil)
în al doilea rând, sinteza este raportată ca fiind stereospecifică pe baza substratului de plecare. adică, reducerea d-amf va produce d-meth și același lucru pentru izomerul l. structura așa cum este prezentată (3) nu posedă centre chirale, iar reducerea sa este echivalentă cu aminarea reductivă standard a fenilacetonei care produce un produs racemic. structura propusă pe care am dat-o pentru intermediar posedă un centru chiral, care ar fi același cu cel al materialului de plecare și, prin urmare, corespunde stereospecificității observate a reacției.
dacă am dreptate, acest lucru ar clarifica problemele legate de stereospecificitatea reacției de mai devreme. dacă am făcut o greșeală undeva, îmi cer scuze, dar eram curios de ce reducerea non-chiralului (3) duce la un amestec non-racemic de produse atunci când se utilizează un material de plecare amfetaminic non-racemic.
Bună ziua. În primul rând, a-carbonul are o densitate electronică mai mare decât metil carbonul. Mecanismul tipic conduce la un astfel de intermediar (ascuns sub filigranul Breaking Bad, sry):
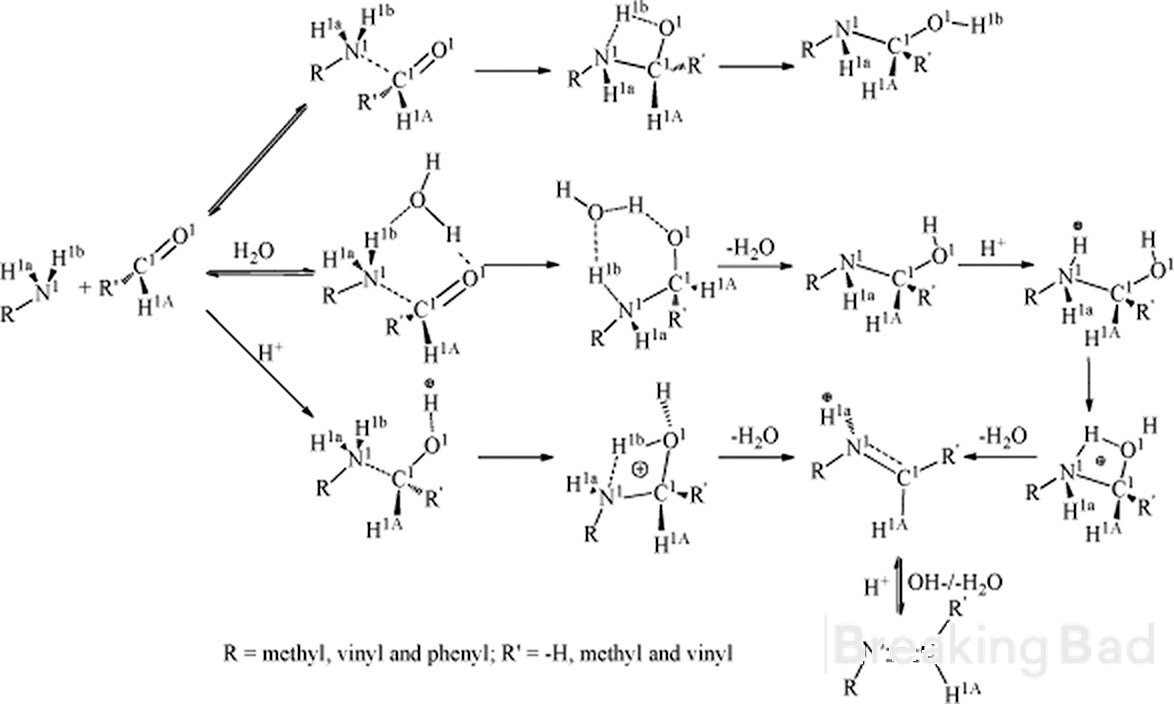
În al doilea rând, aveți date fiabile despre rezultatul stereo-specific al acestei sinteze?
În al doilea rând, aveți date fiabile despre rezultatul stereo-specific al acestei sinteze?
↑View previous replies…
- By NexusPrime
rhodium este o greșeală, dubla legătură nu există, a se vedea exemplul cu benzaldehida de mai jos
