Agilent1100DAD
Newbie
Итак, ребята! Пора поделиться с вами знаниями. Я опишу синтез псилоцина, который я провел, сопроводив его фотографиями. Я использовал полученный псилоцин и разработал простой клейкий пластырь. Чтобы проверить проницаемость псилоцина в пластыре, мы использовали диффузионный аппарат, который я собрал. Он включает в себя несколько мембран, при этом пластырь площадью 1 см^2 помещается поверх кусочка свежей человеческой кожи площадью 1 см^2 и толщиной 400 мкм (предоставлен из хирургического центра по подтяжке живота). Под кожей находится постоянный поток воды с pH 7,4 и температурой тела. Диффузионный аппарат способен собирать фракцию объемом 1 мл в час, которая затем анализируется с помощью ЖХ-МС. Количество псилоцина в пробирке объемом 1 мл дает поток (мг/час/см^2). Это определяет, сколько псилоцина проходит в час при размере пластыря см^2.
В следующей публикации "Определение структуры и спектроскопический анализ хромофоров, образующихся при окислительной димеризации псилоцина" этот вопрос рассматривается более подробно. Когда образуется димер, его невозможно обнаружить с помощью ВЭЖХ-анализа и ATR-FTIR, что очень странно. Это дает исследовательским группам ложные результаты о чистоте псилоцина. Я нашел способ стабилизировать псилоцин в пластыре.
Итак, начнем! Каждый шаг я делал сам, с помощью своего партнера, инженера-химика. Это было еще тогда, когда у меня была лицензия УБН по спискам 1 и 3 не только на исследования, но и на производство.
Часть I (Синтез псилоцина)
шаг 1: синтез 3-[2-(Диметиламино)-2-оксоацетил]-1H-индол-4-ил-ацетата
1a. Четырехгорлую круглодонную колбу объемом 2000 мл оснастили верхней мешалкой, регулятором температуры J-Kem, капельной воронкой объемом 250 мл и резиновой перегородкой, через которую под положительным давлением подавали сухой N2. Перегородка была удалена, и в колбу эквивалентно загрузили 1H-индол-4-илацетат (5; 50,1 г, 285 ммоль, 1 эквив)
и ангидридом Et2O (700 мл). Колбу закрыли перегородкой и промыли N2. Суспензию перемешивали в течение 10 мин, а затем
охлаждали до 0 °C в водяной бане со льдом в течение 30 минут.

1b. В капельную воронку поместили раствор оксалилхлорида (37,1 мл, 428 ммоль, 1,5 экв.) в Et2O (60 мл). Раствор оксалилхлорида добавляли по каплям со скоростью, достаточной для поддержания температуры на уровне или ниже 5 °C, чтобы минимизировать образование димеров и других возможных побочных продуктов. По мере добавления образовывалась желтая суспензия 10, и после завершения добавления смесь перемешивали в течение 4 ч.

1c. По истечении этого времени добавили гептан (400 мл) и смесь перемешивали в течение 30 мин при 0 °C. Полученное желтое твердое вещество быстро отфильтровали и последовательно промыли гептаном (2 × 300 мл), который быстро использовали на следующем этапе. . 2,0 М раствор диметиламина в THF (175 мл) добавляли по каплям со скоростью, достаточной для поддержания температуры ниже 5 °C, чтобы минимизировать побочные реакции. После
После завершения добавления пиридин (46 мл) в THF (100 мл) добавляли по каплям, и смесь хорошо перемешивали в течение 60 минут. Добавили гептан (600 мл) и отфильтровали содержимое колбы через воронку Бюхнера. Отфильтрованный остаток перенесли в круглодонную колбу, добавили деионизированную H2O (1000 мл), перемешивали в течение 30 мин и отфильтровали через воронку Бюхнера. Белое твердое вещество последовательно тритурировали в течение 40 мин в EtOAc (600 мл) и гептане (400 мл). Суспензию отфильтровали через воронку Бюхнера, твердое вещество высушили в печи при 40 °C в течение ночи и получили 6 в виде светло-желтого твердого вещества; выход: 66,1 г (81%); mp 205-207 °C.



АТР-Фурье подтвердило синтез 3-[2-(Диметиламино)-2-оксоацетил]-1H-индол-4-ил-ацетата. Это соединение можно хранить при 4C в течение нескольких месяцев!
Шаг 2: Синтез псилоцина
Шаг 2А: В четырехгорлую круглодонную колбу объемом 2000 мл установили верхнюю мешалку, регулятор температуры J-Kem, капельную воронку объемом 250 мл.
250 мл капельной воронкой и резиновой перегородкой, через которую под положительным давлением подавался сухой N2. Перегородка была удалена, и в колбу
в колбу последовательно загружали 3-[2-(диметиламино)-2-оксоацетил]-1H-индол-4-илацетат (6; 31,5 г, 115 ммоль) и 2-CH3-THF (1000
мл). Колбу погрузили в ледяную баню при 0 °C и добавили раствор 2,3 М LiAlH4 в 2-CH3-THF (140 мл, 322 ммоль) через капельную воронку объемом 250 мл.
через 250 мл капельную воронку. Воронку промыли дополнительным количеством 2-CH3-THF (20 мл). Раствор LiAlH4 добавляли по каплям
со скоростью, обеспечивающей поддержание температуры ниже 20 °C. После добавления льда водяную баню удаляли и смесь перемешивали в течение 30 мин.
Светло-желтый раствор нагревали до рефлюкса (80 °C) с помощью нагревательной мантии, и через 3 ч он приобрел цвет слоновой кости.
желтых твердых частиц на стенках круглодонной колбы.



Шаг 2C. Нагревательную мантию убрали, и колбу охладили до 50 °C. Колбу снова
охладили до 20 °C. Реакцию гасили последовательным добавлением 3 капель 1 М NaOH и 3 капель деионизированной H2O. Смесь
разбавляли THF (500 мл) и перемешивали в течение 20 мин. Смесь фильтровали через воронку Бюхнера, а фильтрат хранили при N2.
Кек быстро перемешивали с 200 мл [10%-ного раствора (7% аммиака в MeOH) в CH2Cl2] и THF (500 мл). Фильтраты
объединили и сконцентрировали с получением зеленого твердого вещества. Твердое вещество тритурировали с 1:1 EtOAc/гептан (50 мл), затем отфильтровали через воронку Бюхнера.
воронку Бюхнера. Темно-зеленое твердое вещество сушили в печи при 40 °C в течение ночи с получением сухого псилоцина (7) в виде темно-зеленого твердого вещества; выход: 20,7
г (91 %); mp 167-169 °C.
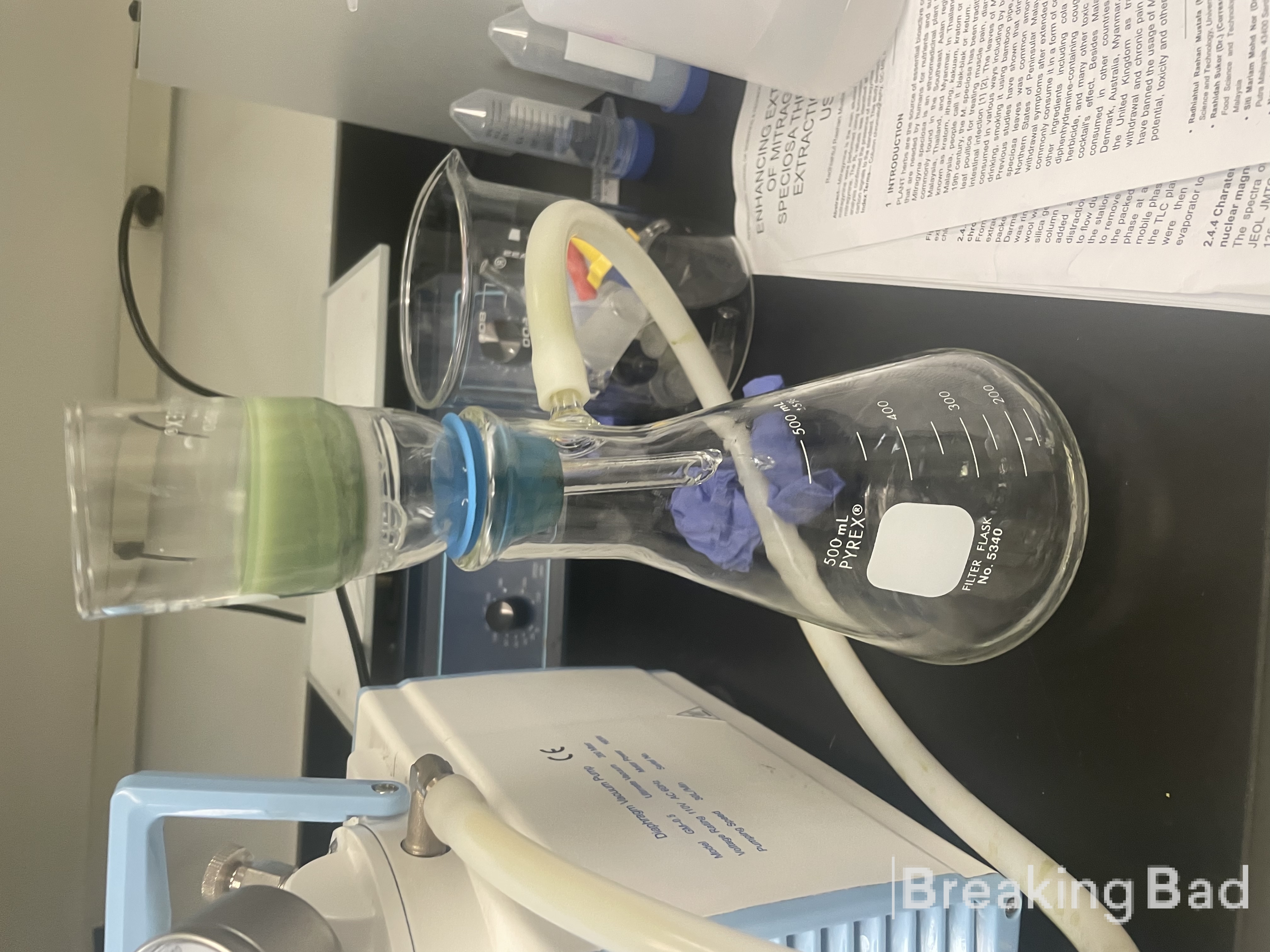


Псилоцин был синтезирован.
Часть II: Разработка трансдермального пластыря с псилоцином и исследование in-vitro (ВНИМАНИЕ: ВЫ БУДЕТЕ ВИДЕТЬ СВЕЖУЮ ЧЕЛОВЕЧЕСКУЮ ПЛОТЬ, ЭТО ЖУТКО!
Затем я растворяю псилоцин в запатентованной смеси акрилатных полимеров (в гептане), затем заливаю раствор в разделительную линию и с помощью ножа для литья добиваюсь адгезивного слоя до 100 мкм. После высыхания я наношу слой подложки и вырезаю пластырь площадью 1 см^2. Этот пластырь используется для исследования in vitro.
На следующей фотографии - снимок диффузионного аппарата (пластырь на коже, под ним течет вода).

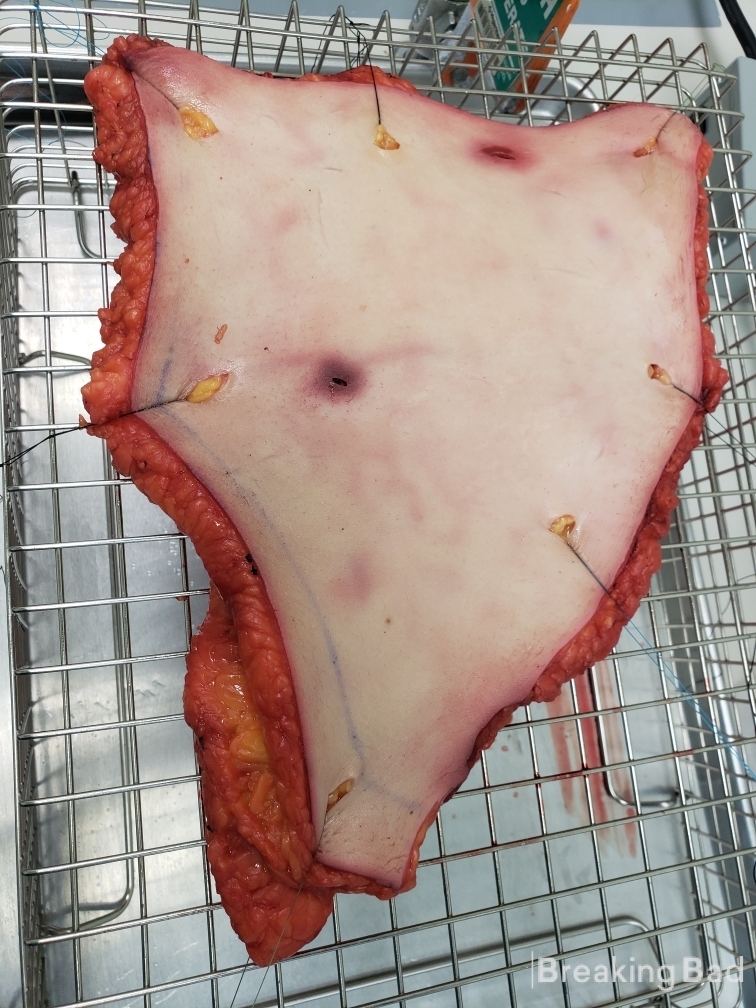
Надеюсь, вам понравилось!
В следующей публикации "Определение структуры и спектроскопический анализ хромофоров, образующихся при окислительной димеризации псилоцина" этот вопрос рассматривается более подробно. Когда образуется димер, его невозможно обнаружить с помощью ВЭЖХ-анализа и ATR-FTIR, что очень странно. Это дает исследовательским группам ложные результаты о чистоте псилоцина. Я нашел способ стабилизировать псилоцин в пластыре.
Итак, начнем! Каждый шаг я делал сам, с помощью своего партнера, инженера-химика. Это было еще тогда, когда у меня была лицензия УБН по спискам 1 и 3 не только на исследования, но и на производство.
Часть I (Синтез псилоцина)
шаг 1: синтез 3-[2-(Диметиламино)-2-оксоацетил]-1H-индол-4-ил-ацетата
1a. Четырехгорлую круглодонную колбу объемом 2000 мл оснастили верхней мешалкой, регулятором температуры J-Kem, капельной воронкой объемом 250 мл и резиновой перегородкой, через которую под положительным давлением подавали сухой N2. Перегородка была удалена, и в колбу эквивалентно загрузили 1H-индол-4-илацетат (5; 50,1 г, 285 ммоль, 1 эквив)
и ангидридом Et2O (700 мл). Колбу закрыли перегородкой и промыли N2. Суспензию перемешивали в течение 10 мин, а затем
охлаждали до 0 °C в водяной бане со льдом в течение 30 минут.
1b. В капельную воронку поместили раствор оксалилхлорида (37,1 мл, 428 ммоль, 1,5 экв.) в Et2O (60 мл). Раствор оксалилхлорида добавляли по каплям со скоростью, достаточной для поддержания температуры на уровне или ниже 5 °C, чтобы минимизировать образование димеров и других возможных побочных продуктов. По мере добавления образовывалась желтая суспензия 10, и после завершения добавления смесь перемешивали в течение 4 ч.
1c. По истечении этого времени добавили гептан (400 мл) и смесь перемешивали в течение 30 мин при 0 °C. Полученное желтое твердое вещество быстро отфильтровали и последовательно промыли гептаном (2 × 300 мл), который быстро использовали на следующем этапе. . 2,0 М раствор диметиламина в THF (175 мл) добавляли по каплям со скоростью, достаточной для поддержания температуры ниже 5 °C, чтобы минимизировать побочные реакции. После
После завершения добавления пиридин (46 мл) в THF (100 мл) добавляли по каплям, и смесь хорошо перемешивали в течение 60 минут. Добавили гептан (600 мл) и отфильтровали содержимое колбы через воронку Бюхнера. Отфильтрованный остаток перенесли в круглодонную колбу, добавили деионизированную H2O (1000 мл), перемешивали в течение 30 мин и отфильтровали через воронку Бюхнера. Белое твердое вещество последовательно тритурировали в течение 40 мин в EtOAc (600 мл) и гептане (400 мл). Суспензию отфильтровали через воронку Бюхнера, твердое вещество высушили в печи при 40 °C в течение ночи и получили 6 в виде светло-желтого твердого вещества; выход: 66,1 г (81%); mp 205-207 °C.
АТР-Фурье подтвердило синтез 3-[2-(Диметиламино)-2-оксоацетил]-1H-индол-4-ил-ацетата. Это соединение можно хранить при 4C в течение нескольких месяцев!
Шаг 2: Синтез псилоцина
Шаг 2А: В четырехгорлую круглодонную колбу объемом 2000 мл установили верхнюю мешалку, регулятор температуры J-Kem, капельную воронку объемом 250 мл.
250 мл капельной воронкой и резиновой перегородкой, через которую под положительным давлением подавался сухой N2. Перегородка была удалена, и в колбу
в колбу последовательно загружали 3-[2-(диметиламино)-2-оксоацетил]-1H-индол-4-илацетат (6; 31,5 г, 115 ммоль) и 2-CH3-THF (1000
мл). Колбу погрузили в ледяную баню при 0 °C и добавили раствор 2,3 М LiAlH4 в 2-CH3-THF (140 мл, 322 ммоль) через капельную воронку объемом 250 мл.
через 250 мл капельную воронку. Воронку промыли дополнительным количеством 2-CH3-THF (20 мл). Раствор LiAlH4 добавляли по каплям
со скоростью, обеспечивающей поддержание температуры ниже 20 °C. После добавления льда водяную баню удаляли и смесь перемешивали в течение 30 мин.
Светло-желтый раствор нагревали до рефлюкса (80 °C) с помощью нагревательной мантии, и через 3 ч он приобрел цвет слоновой кости.
желтых твердых частиц на стенках круглодонной колбы.
Шаг 2C. Нагревательную мантию убрали, и колбу охладили до 50 °C. Колбу снова
охладили до 20 °C. Реакцию гасили последовательным добавлением 3 капель 1 М NaOH и 3 капель деионизированной H2O. Смесь
разбавляли THF (500 мл) и перемешивали в течение 20 мин. Смесь фильтровали через воронку Бюхнера, а фильтрат хранили при N2.
Кек быстро перемешивали с 200 мл [10%-ного раствора (7% аммиака в MeOH) в CH2Cl2] и THF (500 мл). Фильтраты
объединили и сконцентрировали с получением зеленого твердого вещества. Твердое вещество тритурировали с 1:1 EtOAc/гептан (50 мл), затем отфильтровали через воронку Бюхнера.
воронку Бюхнера. Темно-зеленое твердое вещество сушили в печи при 40 °C в течение ночи с получением сухого псилоцина (7) в виде темно-зеленого твердого вещества; выход: 20,7
г (91 %); mp 167-169 °C.
Псилоцин был синтезирован.
Часть II: Разработка трансдермального пластыря с псилоцином и исследование in-vitro (ВНИМАНИЕ: ВЫ БУДЕТЕ ВИДЕТЬ СВЕЖУЮ ЧЕЛОВЕЧЕСКУЮ ПЛОТЬ, ЭТО ЖУТКО!
Затем я растворяю псилоцин в запатентованной смеси акрилатных полимеров (в гептане), затем заливаю раствор в разделительную линию и с помощью ножа для литья добиваюсь адгезивного слоя до 100 мкм. После высыхания я наношу слой подложки и вырезаю пластырь площадью 1 см^2. Этот пластырь используется для исследования in vitro.
На следующей фотографии - снимок диффузионного аппарата (пластырь на коже, под ним течет вода).
Надеюсь, вам понравилось!


