G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,730
- Solutions
- 3
- Reaction score
- 2,899
- Points
- 113
- Deals
- 1
Reakcie s Grignardovými činidlami.
Grignardovo činidlo má vzorec RMgX, kde X je halogén a R je alkylová alebo arylová (na báze benzénového kruhu) skupina. Na účely tejto témy budeme za R považovať alkylovú skupinu (napr. BuMgBr). Grignardove činidlá sa vyrábajú pridaním halogenoalkánu k malým kúskom horčíka v banke obsahujúcej dietyléter. Banka je vybavená spätným chladičom a zmes sa zahrieva na vodnom kúpeli 20 - 30 minút.
Všetko musí byť dokonale suché, pretože Grignardove činidlá reagujú s vodou (pozri ďalej). Všetky reakcie s použitím Grignardovho činidla sa vykonávajú so zmesou získanou z tejto reakcie. Nemôžete ju nijakým spôsobom oddeliť.
Grignardove činidlá a voda.
Grignardove činidlá reagujú s vodou za vzniku alkánov. To je dôvod, prečo musí byť všetko počas uvedenej prípravy veľmi suché. Napríklad:Anorganický produkt Mg(OH)Br sa označuje ako "bázický bromid" a je akýmsi medzistupňom medzi bromidom horečnatým a hydroxidom horečnatým.
Všeobecná reakcia medzi Grignardmi a karbonylmi.
Reakcie medzi rôznymi druhmi karbonylových zlúčenín a Grignardovými činidlami môžu vyzerať dosť komplikovane, ale v skutočnosti všetky reagujú rovnako - menia sa len skupiny pripojené k dvojitej väzbe uhlík - kyslík. Je oveľa jednoduchšie pochopiť, čo sa deje, ak sa pozorne pozriete na všeobecný prípad (s použitím skupín "R" namiesto špecifických skupín) - a potom v prípade potreby dosadíte rôzne skutočné skupiny.
Reakcie sú v podstate identické s reakciou s oxidom uhličitým - líši sa len povaha organického produktu. V prvej fáze sa Grignardovo činidlo pridáva cez dvojitú väzbu uhlíka a kyslíka.
Reakcie sú v podstate identické s reakciou s oxidom uhličitým - líši sa len povaha organického produktu. V prvej fáze sa Grignardovo činidlo pridáva cez dvojitú väzbu uhlíka a kyslíka.
Potom sa k nemu pridá zriedená kyselina, ktorá ho hydrolyzuje. (Používam bežne uznávanú rovnicu, pričom ignorujem skutočnosť, že Mg(OH)Br bude ďalej reagovať s kyselinou).
Vzniká alkohol. Jedným z kľúčových použití Grignardových činidiel je možnosť ľahko vyrobiť komplikované alkoholy. Akýdruh alkoholu dostanete, závisí od karbonylovej zlúčeniny, s ktorou ste začali - inými slovami, aké sú R a R'.
Grignardove činidlá sa široko používajú na syntézu rôznych tried organických zlúčenín. Niektoré príklady sú uvedené nižšie.
:
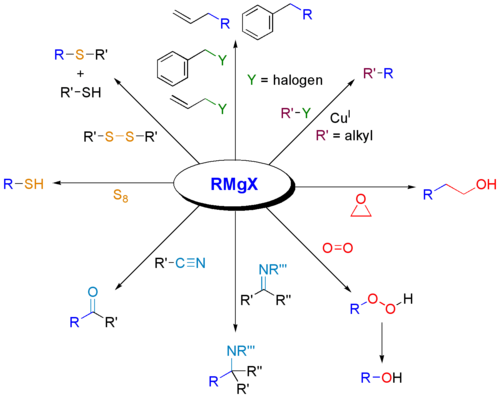
Prečo reagujú Grignardove činidlá s karbonylmi?
Väzba medzi atómom uhlíka a horčíka je polárna. Uhlík je elektronegatívnejší ako horčík, a preto je väzbový pár elektrónov ťahaný smerom k uhlíku. To zanecháva atóm uhlíka s mierne záporným nábojom.
Dvojná väzba medzi uhlíkom a kyslíkom je tiež veľmi polárna, pričom atóm uhlíka má značný kladný náboj. Grignardovo činidlo preto môže slúžiť ako nukleofil, pretože sa priťahuje medzi mierne záporným atómom uhlíka v Grignardovom činidle a kladným atómom uhlíka v karbonylovej zlúčenine. Nukleofil je záporný (alebo mierne záporný) atóm, ktorý napáda kladné (alebo mierne kladné) centrá v iných molekulách alebo iónoch.
Príprava Grignardovho činidla, fenylmagnéziumbromidu.
Grignardove činidlá zohrávajú v organickej syntéze vedúcu úlohu. Tieto zlúčeniny sa dajú prispôsobiť na prípravu veľkého množstva funkčných skupín a tvorba a reakcia organohalogénderivátov je jedným z hlavných použití alkylhalogenidov v organickej syntéze. Reakcia halogenidu a horčíka prebieha na povrchu kovu a formálne ide o oxidáciu kovu. Reakcia sa zvyčajne uskutočňuje v suchom éterovom rozpúšťadle, pričom éter funguje ako Lewisova zásada, pretože solvatuje Grignardovo činidlo a umožňuje mu difundovať od kovu. Tvorba organokovového činidla si vyžaduje aktívny povrch kovu, pričom môže dôjsť k určitým ťažkostiam pri začatí reakcie kvôli oxidom kovov na povrchu kovu. Niekoľkominútové mletie horčíka v mažiari pred použitím je často účinné na zabezpečenie čistého povrchu. Ďalším užitočným trikom pri začatí reakcie je pridanie malého kryštálu jódu do zmesi, ktorý reaguje s horčíkom za vzniku veľmi reaktívnej soli jodidu horečnatého (MgI2).
Postup.
Grignardovo činidlo sa pripraví tak, že sa najprv na suchú 250 ml banku s okrúhlym dnom nasadí sušiaca trubička s CaCl2. Do banky sa vloží horčík, ktorý sa má použiť (2 g = 0,082 mólu horčíkových obratov), priamo sa pripojí trubica s chloridom vápenatým a banka sa dôkladne zahreje pomocou veľkého ohrievacieho telesa a reostatu. Nastavte regulátor veľkého ohrievacieho mantinelu na hodnotu "6" a zahrievajte banku, kým nie je príliš horúca na to, aby ste sa jej mohli dotknúť prstom. Pri chladnutí sa v banke cez chlorid vápenatý nahromadí suchý vzduch. Pred pokračovaním odstráňte ohrievací plášť a ochlaďte na izbovú teplotu (banka by mala byť na dotyk ruky len mierne teplá alebo chladnejšia). Odstráňte rúrku na sušenie chloridu vápenatého a do 250-banónky s okrúhlym dnom nalejte 15 ml absolútneho éteru a 9 ml (13,5 g = 0,086 mólu) bromobenzénu. Vymeňte skúmavku na sušenie CaCl2. Ak nedôjde k okamžitému prejavu reakcie, iniciujte reakciu rozdrvením niektorých horčíkových obalov. To sa vykoná tak, že sa vloží suchá miešacia tyčinka so splošteným koncom a opatrne sa rozdrví kúsok horčíka pevne o dno banky pod hladinou kvapaliny, pričom sa tyčinka krúti. Keď sa to urobí správne, kvapalina sa mierne zakalí a na povrchu stlačeného kovu začnú rýchlo bublať bublinky. V tomto okamihupridajte ďalších 25 ml absolútneho éteru a na banku pripojte spätný chladič a na vrch spätného chladiča pripojte hadičku CaCl2, ako je znázornené na obrázku.
Nezačnite prepúšťať vodu cez kondenzátor, kým éterové pary nezvlhčia spoj v hornej časti kondenzátora. Ak je to potrebné, ochlaďte banku dotykom dna banky s ľadovým kúpeľom, aby ste spomalili reakciu, ale nepoužívajte ho, ak to nie je nevyhnutné. Je to potrebné len vtedy, ak éterové pary vychádzajú z hornej časti sušiacej trubice. Ak musíte reakciu ochladiť, dávajte pozor, aby ste reakciu príliš nespomalili, inak sa môže zastaviť a po odstránení ľadu sa už nespustí. Každých šesťdesiat sekúnd banku intenzívne roztočte. Po začatí reakcie môže byť samovoľný var v zriedenej zmesi pomalý alebo sa môže stať pomalým. V takom prípade pridajte do banky niekoľko ďalších ml bromobenzénu. Reakcia je ukončená, keď éter prestane bublať a zostane len niekoľko malých zvyškov kovu. Označte hladinu éteru v banke. Počas reakcie skontrolujte, či sa objem éteru nezmenšil. Ak áno, pridajte viac suchého éteru. Keďže roztok Grignardovho činidla sa pri státí zhoršuje, ďalší krok by sa mal začať ihneď.
Kondenzácia Grignardovho činidla s metylbenzoátom.
Kondenzácia Grignardovho činidla s metylbenzoátom.
V oddeľovacom lieviku zmiešajte 5 g (0,037 mólu; 1,09 g/ml) metylbenzoátu a 15 ml absolútneho éteru, banku obsahujúcu roztok Grignardovho činidla krátko ochlaďte v ľadovom kúpeli. Odstráňte sušiacu skúmavku a do hornej časti kondenzátora vložte Claisenov adaptér a oddeľovací lievik, ako je znázornené vpravo. Roztok metylbenzoátu vlievajte po kvapkách počas desiatich minút, pričom chladenie je len také, aké je potrebné na kontrolu exotermickej reakcie. Produktová soľ sa počas tohto kroku oddelí ako biela pevná látka. Kolbu v pravidelných intervaloch otáčajte, až kým reakcia neustane a banka nebude mať izbovú teplotu. Prejditepriamo na ďalší krok.
Hydrolýza produktu adície.
Hydrolýza produktu adície.
Reakčnú zmes opatrne prelejte do 250 ml Erlenmeyerovej banky obsahujúcej 50 ml 10 % kyseliny sírovej a približne 25 g ľadu. Na vypláchnutie reakčnej banky použite niekoľko ml obyčajného (bezvodého) éteru a niekoľko ml 10 % kyseliny sírovej. Tieto výplachy pridajte do Erlenmeyerovej banky. Dobre premiešajte, aby ste podporili hydrolýzu adičnej zlúčeniny; zásadité horečnaté soli sa premenia na vo vode rozpustné neutrálne soli a trifenylkarbinol sa rozdelí do éterovej vrstvy. Ak sa pôvodná éterová vrstva odparovaním príliš znížila, môže byť potrebné ďalšie množstvo éteru (obyčajného). V tomto bode môžete skončiť, ak nie je dostatok času na dokončenie ďalšej časti. Označenú Erlenmeyerovu nádobu uložte do digestora s ľahko pripevnenou korkovou (nie gumovou) zátkou. Zátka by mala byť dostatočne voľná, aby sa uvoľnil akýkoľvek tlak plynu z vyvíjajúceho sa plynného vodíka.
Keď sa nespotrebovaný kovový Mg dostane do kontaktu s kyselinou, dôjde k intenzívnemu vývinu plynného vodíka a reakčná zmes môže speniť, ak je pridávanie príliš rýchle.
Izolácia produktu.
Ak má vaša éterová vrstva pevné biele kryštály, ide o kryštály produktu, ktoré sa vytvorili, pretože sa odparila časť éterovej vrstvy. Tieto kryštály možno izolovať tak, že zmes nalejete do oddeľovacieho lievika cez sklenený lievik s malou zátkou zo sklenej vaty v stopke. Kryštály opláchnite malým množstvom éterového rozpúšťadla. Ak chcete izolovať zvyšný produkt, vypláchnite Erlenmeyerovu banku, z ktorej ste vyliali pôvodný roztok, niekoľkými ml obyčajného éteru a pridajte ho do oddeľovacieho lievika. Lievikom potraste, pričom sa uistite, že ste odvzdušnili nahromadený plyn v lieviku. Odčerpajte vodnú vrstvu. Eterovú vrstvu pretrepte 10 % kyselinou sírovou, aby sa ďalej odstránili soli horčíka, a odstráňte vrstvu kyseliny sírovej. Premyte éterovú vrstvu nasýteným roztokom chloridu sodného, aby ste odstránili vodu, ktorá sa rozpustila v éteri. Odstráňte roztok chloridu sodného. Množstvo kvapaliny použitej pri týchto premývacích operáciách nie je rozhodujúce. Vo všeobecnosti postačuje množstvo premývacej kvapaliny rovnajúce sa jednej tretine objemu éteru. Na konečné vysušenie éterového roztoku prelejte éterovú vrstvu z hrdla oddeľovacieho lievika do Erlenmeyerovej banky, pridajte približne 5 g granulovaného bezvodého síranu sodného, občas banku roztočte a po 5 minútach dekantujte éter z pevného sušiaceho činidla do inej čistej, suchej Erlenmeyerovej banky. Do éterického roztoku pridajte 25 ml ligroínu a banku zazátkujte korkovou zátkou. Zmes nechajte odstáť cez noc alebo do nasledujúceho laboratórneho obdobia. Po odstátí by sa mali vytvoriť kryštály trifenylkarbinolu. Hlavná nečistota bifenyl by mala zostať rozpustná v rozpúšťadle na rekryštalizáciu. Kryštály filtrujte odsávacou filtráciou do sucha. Zaznamenajte hmotnosť izolovaného produktu a vypočítajte výťažok v %. Stanovte teplotu topenia.
Keď sa nespotrebovaný kovový Mg dostane do kontaktu s kyselinou, dôjde k intenzívnemu vývinu plynného vodíka a reakčná zmes môže speniť, ak je pridávanie príliš rýchle.
Izolácia produktu.
Ak má vaša éterová vrstva pevné biele kryštály, ide o kryštály produktu, ktoré sa vytvorili, pretože sa odparila časť éterovej vrstvy. Tieto kryštály možno izolovať tak, že zmes nalejete do oddeľovacieho lievika cez sklenený lievik s malou zátkou zo sklenej vaty v stopke. Kryštály opláchnite malým množstvom éterového rozpúšťadla. Ak chcete izolovať zvyšný produkt, vypláchnite Erlenmeyerovu banku, z ktorej ste vyliali pôvodný roztok, niekoľkými ml obyčajného éteru a pridajte ho do oddeľovacieho lievika. Lievikom potraste, pričom sa uistite, že ste odvzdušnili nahromadený plyn v lieviku. Odčerpajte vodnú vrstvu. Eterovú vrstvu pretrepte 10 % kyselinou sírovou, aby sa ďalej odstránili soli horčíka, a odstráňte vrstvu kyseliny sírovej. Premyte éterovú vrstvu nasýteným roztokom chloridu sodného, aby ste odstránili vodu, ktorá sa rozpustila v éteri. Odstráňte roztok chloridu sodného. Množstvo kvapaliny použitej pri týchto premývacích operáciách nie je rozhodujúce. Vo všeobecnosti postačuje množstvo premývacej kvapaliny rovnajúce sa jednej tretine objemu éteru. Na konečné vysušenie éterového roztoku prelejte éterovú vrstvu z hrdla oddeľovacieho lievika do Erlenmeyerovej banky, pridajte približne 5 g granulovaného bezvodého síranu sodného, občas banku roztočte a po 5 minútach dekantujte éter z pevného sušiaceho činidla do inej čistej, suchej Erlenmeyerovej banky. Do éterického roztoku pridajte 25 ml ligroínu a banku zazátkujte korkovou zátkou. Zmes nechajte odstáť cez noc alebo do nasledujúceho laboratórneho obdobia. Po odstátí by sa mali vytvoriť kryštály trifenylkarbinolu. Hlavná nečistota bifenyl by mala zostať rozpustná v rozpúšťadle na rekryštalizáciu. Kryštály filtrujte odsávacou filtráciou do sucha. Zaznamenajte hmotnosť izolovaného produktu a vypočítajte výťažok v %. Stanovte teplotu topenia.
Syntézy psychoaktívnych látok pomocou Grignardovho činidla.
Grignardovo činidlo sa používa pri syntéze viacerých povrchovo aktívnych látok. Napríklad pri syntéze syntetických kanabinoidov na pripojenie alkylovej skupiny k atómu indolového dusíka (pozri príklad syntézy JWH-018 ). Reakcia prebieha pomerne rýchlo za miernych podmienok a nevyžaduje si zahrievanie.
Nukleofilná adícia Grignardovho činidla umožňuje určitú nešpecifickú a stereošpecifickú reakciu za vzniku amfetamínu a jeho prekurzora, ako je fenyl-2-propanón (P2P).
Ďalšou metódou aplikácie Grignardovho činidla je použitie na ceste k syntéze mefedrónu (4-MMC) s použitím 4-metylbenzaldehydu ako východiskového materiálu.
Reakcia indolylmagnéziumjodidu so substituovanými alkylhalogenidmi, napr. nitrilmi Cl(CH2)nCN a chloroacetyldietylamidom, za vzniku príslušných 3-substituovaných indolov je dobre známa, hoci veľmi reaktívne halogenidy, ako je metyljodid a benzylchlorid, niekedy poskytujú 1,3-disubstituované indoly. Táto cesta DMT je možná s pomocou Grignardovho činidla.
Okrem predchádzajúcich rôznych aplikácií sa tento populárny prístup využíva v kroku syntézy ketamínu pri výrobe (o-chlórfenyl)-cyklopentylketónu.
Záver.
Ako vidíte, Grignardovo činidlo sa vo veľkej miere používa pri organických syntézach a výrobe liečiv čiastočne. Alkyl-halogenidy horčíka (nazývané aj Grignardove činidlá) pôsobia ako nukleofily, útočia na elektrofilný atóm uhlíka a vytvárajú väzbu uhlík-uhlík. Grignardova reakcia je dôležitou metódou na vytváranie väzieb uhlík-uhlík, ako aj väzieb uhlík-heteroatóm. Tento zoznam najobľúbenejších reakcií medzi tajnými chemikmi ukazuje obrovský potenciál pre aplikácie Grignardových činidiel a predstavuje rozsiahle pole pre výskum.
Last edited:
