@G.Patton Domnievam sa, že jeden z nakreslených medziproduktov na tejto syntéze (a z pôvodného článku o ródiu) je nesprávny.
(3), znázornenie amfetamín-formaldehydového imínového medziproduktu má rovnakú štruktúru ako fenylacetón-metylamínový imín, ktorý možno vidieť na inom mieste
nezdá sa mi to správne z dvoch dôvodov: po prvé, nakreslením štandardného mechanizmu vzniku imínu na substráte vzniká imín, v ktorom je dvojitá väzba medzi N a rádoby metylovou skupinou na metamfetamíne, a NIE medzi N a alfa-uhlíkmi ako v uvedenej štruktúre. a zamyslite sa: dvojitá väzba vzniká, keď osamelý pár amínu odkopne vodu vytvorenú na formaldehydovom kyslíku ako odchádzajúcu skupinu, čo sa musí uskutočniť na strane formaldehydu (rádoby metylovej skupiny)
po druhé, syntéza sa uvádza ako stereošpecifická na základe východiskového substrátu. to znamená, že redukciou d-amf sa získa d-meth a to isté pre l-izomér. štruktúra, ako je znázornená (3), nemá žiadne chirálne centrá a jej redukcia je ekvivalentná štandardnej reduktívnej aminácii fenylacetónu, pri ktorej vzniká racemický produkt. navrhovaná štruktúra, ktorú som uviedol pre medziprodukt, má chirálne centrum, ktoré by bolo rovnaké ako u východiskového materiálu, a preto zodpovedá pozorovanej stereošpecificite reakcie.
ak mám pravdu, vyjasnilo by to otázky týkajúce sa stereošpecificity reakcie, ktoré boli uvedené skôr vo vlákne. ak som niekde urobil chybu, ospravedlňujem sa, ale zaujímalo ma, prečo redukcia nechirálneho (3) vedie k neracemickej zmesi produktov, keď sa použije neracemický východiskový materiál amfetamín.
(3), znázornenie amfetamín-formaldehydového imínového medziproduktu má rovnakú štruktúru ako fenylacetón-metylamínový imín, ktorý možno vidieť na inom mieste
nezdá sa mi to správne z dvoch dôvodov: po prvé, nakreslením štandardného mechanizmu vzniku imínu na substráte vzniká imín, v ktorom je dvojitá väzba medzi N a rádoby metylovou skupinou na metamfetamíne, a NIE medzi N a alfa-uhlíkmi ako v uvedenej štruktúre. a zamyslite sa: dvojitá väzba vzniká, keď osamelý pár amínu odkopne vodu vytvorenú na formaldehydovom kyslíku ako odchádzajúcu skupinu, čo sa musí uskutočniť na strane formaldehydu (rádoby metylovej skupiny)
po druhé, syntéza sa uvádza ako stereošpecifická na základe východiskového substrátu. to znamená, že redukciou d-amf sa získa d-meth a to isté pre l-izomér. štruktúra, ako je znázornená (3), nemá žiadne chirálne centrá a jej redukcia je ekvivalentná štandardnej reduktívnej aminácii fenylacetónu, pri ktorej vzniká racemický produkt. navrhovaná štruktúra, ktorú som uviedol pre medziprodukt, má chirálne centrum, ktoré by bolo rovnaké ako u východiskového materiálu, a preto zodpovedá pozorovanej stereošpecificite reakcie.
ak mám pravdu, vyjasnilo by to otázky týkajúce sa stereošpecificity reakcie, ktoré boli uvedené skôr vo vlákne. ak som niekde urobil chybu, ospravedlňujem sa, ale zaujímalo ma, prečo redukcia nechirálneho (3) vedie k neracemickej zmesi produktov, keď sa použije neracemický východiskový materiál amfetamín.
Dobrý deň. po prvé, uhlík a má väčšiu elektrónovú hustotu ako metyl uhlík. Typický mechanizmus vedie k takémuto medziproduktu (skrytý pod vodoznakom Breaking Bad, sry):
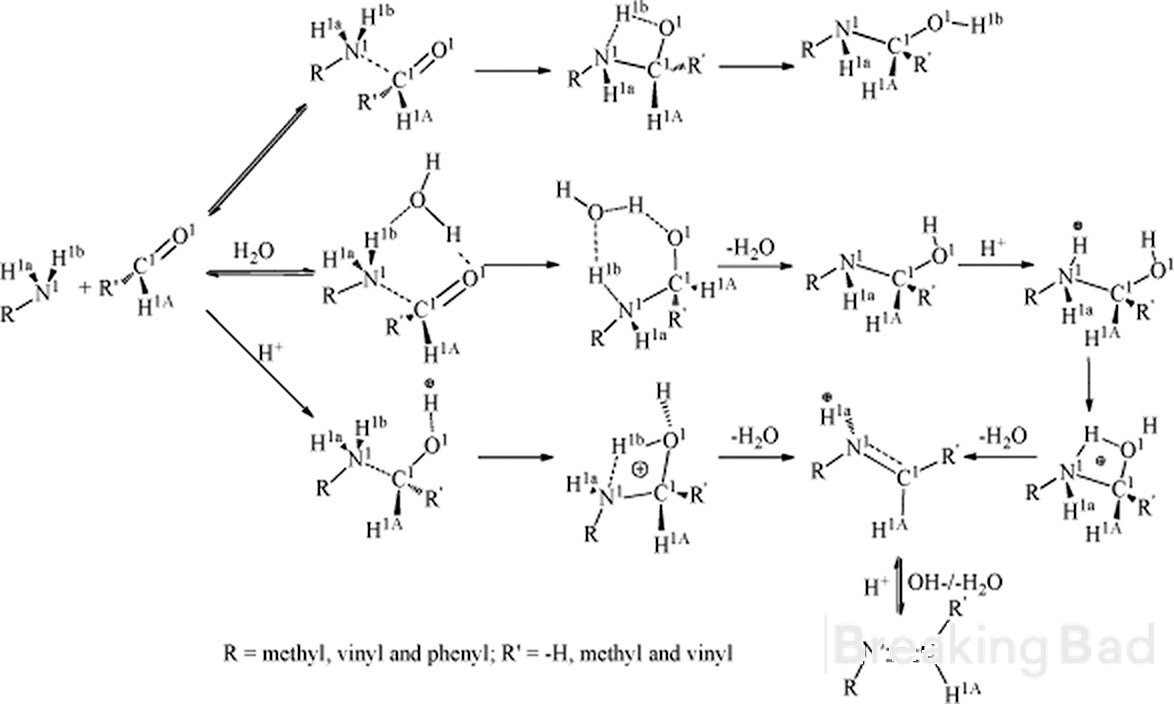
Po druhé, máte nejaké spoľahlivé údaje o stereo špecifickom výsledku tejto syntézy?
Po druhé, máte nejaké spoľahlivé údaje o stereo špecifickom výsledku tejto syntézy?
