G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,730
- Solutions
- 3
- Reaction score
- 2,899
- Points
- 113
- Deals
- 1
Reakcije z Grignardovimi reagenti.
Grignardov reagent ima formulo RMgX, kjer je X halogen, R pa je alkilna ali arilna (na osnovi benzenovega obroča) skupina. Za namene te teme bomo za R šteli alkilno skupino (npr. BuMgBr). Grignardove reagente pripravimo tako, da v erlenmajerico z dietiletrom dodamo halogenoalkan majhnim koščkom magnezija. Bučka je opremljena s povratnim hladilnikom, zmes pa se 20 do 30 minut segreva na vodni kopeli.
Vse mora biti popolnoma suho, ker reagenti Grignard reagirajo z vodo (glej spodaj). Vse reakcije z uporabo Grignardovega reagenta izvajamo z zmesjo, ki nastane pri tej reakciji. Nanoben način je ne morete ločiti.
Grignardovi reagenti in voda.
Grignardovi reagenti reagirajo z vodo, pri čemer nastanejo alkani. To je razlog, da mora biti med zgornjo pripravo vse zelo suho. Na primer:Anorganski produkt, Mg(OH)Br, se imenuje "bazični bromid" in je nekakšna vmesna stopnja med magnezijevim bromidom in magnezijevim hidroksidom.
Splošna reakcija med Grignardom in karbonili.
Reakcije med različnimi vrstami karbonilnih spojin in Grignardovimi reagenti so lahko videti precej zapletene, vendar dejansko vse reagirajo na enak način - spremenijo se le skupine, vezane na dvojno vez ogljik-kisik. Veliko lažje je razumeti, kaj se dogaja, če si natančno ogledamo splošni primer (z uporabo skupin "R" namesto posebnih skupin) in nato po potrebi vstavimo različne prave skupine.
Reakcije so v bistvu enake reakciji z ogljikovim dioksidom - razlikuje se le narava organskega produkta. V prvi fazi Grignardov reagent doda dvojno vez med ogljikom in kisikom.
Reakcije so v bistvu enake reakciji z ogljikovim dioksidom - razlikuje se le narava organskega produkta. V prvi fazi Grignardov reagent doda dvojno vez med ogljikom in kisikom.
Temu se nato doda razredčena kislina, ki ga hidrolizira. (Uporabljam običajno sprejeto enačbo, pri čemer zanemarjam dejstvo, da bo Mg(OH)Br nadalje reagiral s kislino).
Nastane alkohol. Ena od ključnih uporab Grignardovih reagentov je možnost enostavne izdelave zapletenih alkoholov. Katerialkohol boste dobili, je odvisno od karbonilne spojine, s katero ste začeli - z drugimi besedami, kakšna sta R in R'.
Grignardovi reagenti se pogosto uporabljajo za sintezo različnih razredov organskih spojin. V nadaljevanju je predstavljenih nekaj primerov.
:
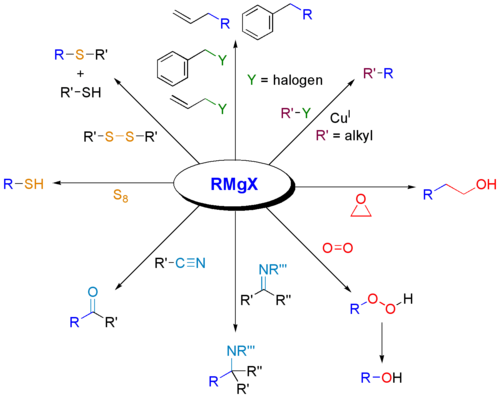
Zakaj Grignardovi reagenti reagirajo s karbonili?
Vez med ogljikovim atomom in magnezijem je polarna. Ogljik je bolj elektronegativen kot magnezij, zato se vezni par elektronov vleče proti ogljiku. Zato ima ogljikov atom rahlo negativen naboj.
Dvojna vez med ogljikom in kisikom je prav tako zelo polarna, saj ima ogljikov atom precejšen pozitivni naboj. Grignardov reagent je zato lahko nukleofil zaradi privlačnosti med rahlo negativnim ogljikovim atomom v Grignardovem reagentu in pozitivnim ogljikom v karbonilni spojini. Nukleofil je negativen (ali rahlo negativen) atom, ki napada pozitivne (ali rahlo pozitivne) centre v drugih molekulah ali ionih.
Priprava Grignardovega reagenta, fenilmagnezijevega bromida.
Grignardovi reagenti imajo vodilno vlogo v organski sintezi. Te spojine je mogoče prilagoditi za pripravo najrazličnejših funkcionalnih skupin, nastanek in reakcija derivatov organomagnezija pa sta ena glavnih uporab alkil halogenidov v organski sintezi. Reakcija halogenida in magnezija poteka na površini kovine in je formalno gledano oksidacija kovine. Reakcija običajno poteka v suhem etrskem topilu, pri čemer eter deluje kot Lewisova baza, saj raztaplja Grignardov reagent in mu omogoča, da difundira stran od kovine. Za nastanek organokovinskega reagenta je potrebna aktivna površina na kovini, pri čemer se reakcija lahko začne s težavo zaradi kovinskih oksidov na kovinski površini. Če magnezij pred uporabo nekaj minut meljemo v možnarju, je to pogosto učinkovito pri zagotavljanju čiste površine. Še en uporaben trik za začetek reakcije je dodajanje majhnega kristala joda zmesi, ki reagira z magnezijem in tvori zelo reaktivno sol magnezijev jodid (MgI2).
Postopek.
Grignardov reagent pripravimo tako, da suho 250-mililitrsko bučko z okroglim dnom najprej opremimo s cevko za sušenje CaCl2. Magnezij, ki ga je treba uporabiti (2 g = 0,082 mola magnezijevih obračalk), damo v erlenmajerico, cevko s kalcijevim kloridom pritrdimo neposredno in erlenmajerico temeljito segrejemo z velikim grelnim loncem in reostatom. Regulator za velik grelni plašč nastavite na nastavitev "6" in erlenmajerico segrevajte, dokler ni prevroča, da bi se je lahko dotaknili s prstom. Ob ohlajanju se v bučki skozi kalcijev klorid pretaka suh zrak. Odstranite grelni plašč in ohladite na sobno temperaturo (erlenmajerica mora biti na roki le rahlo topla ali hladnejša), preden nadaljujete. Odstranite cev za sušenje kalcijevega klorida in v bučko z okroglim dnom 250 vlijte 15 ml absolutnega etra in 9 ml (13,5 g = 0,086 mola) bromobenzena. Zamenjajte epruveto za sušenje CaCl2. Če ni takojšnjih znakov reakcije, sprožite reakcijo tako, da zdrobite nekaj magnezijevih obračalk. To storimo tako, da vstavimo suho mešalno palico s sploščenim koncem in previdno zdrobimo kos magnezija, ki se trdno oprime dna erlenmajerice pod površino tekočine, pri čemer se palica vrti. Ko je to pravilno izvedeno, postane tekočina rahlo motna, na površini stisnjene kovine pa se začnejo hitri mehurčki. Natej točki dodamo še 25 ml absolutnega etra in na erlenmajerico pritrdimo povratni hladilnik, na vrh povratnega hladilnika pa cevko CaCl2, kot je prikazano na sliki.
Ne začnite spuščati vode skozi kondenzator, dokler pare etra ne omočijo spoja na vrhu kondenzatorja. Po potrebi ohladite erlenmajerico z dotikom dna erlenmajerice z ledom, da upočasnite reakcijo, vendar ga ne uporabljajte, če ni nujno. Potrebno je le, če etrski hlapi izhajajo iz vrha sušilne cevi. Če morate reakcijo ohladiti, pazite, da je ne upočasnite preveč, sicer se lahko reakcija ustavi in se po odstranitvi ledu ne začne več. Vsakih šestdeset sekund bučko močno zavrtite. Ko se reakcija začne, je lahko spontano vrenje v razredčeni zmesi počasno ali pa postane počasno. Če je tako, v erlenmajerico dodajte nekaj dodatnih ml bromobenzena. Reakcija je končana, ko eter preneha brbotati in ostane le nekaj majhnih ostankov kovine. Označite raven etra v erlenmajerici. Med reakcijo preverite, ali se prostornina etra ni zmanjšala. Če se je, dodajte še več suhega etra. Ker se raztopina Grignardovega reagenta med stanjem poslabša, je treba takoj začeti naslednji korak.
Kondenzacija Grignardovega reagenta z metil benzoatom.
Kondenzacija Grignardovega reagenta z metil benzoatom.
V ločilnem liju zmešamo 5 g (0,037 mola; 1,09 g/ml) metil benzoata in 15 ml absolutnega etra, bučko z raztopino Grignardovega reagenta za kratek čas ohladimo v ledeni kopeli. Odstranite cevko za sušenje ter vstavite Claisenov nastavek in ločilni lijak v vrh kondenzatorja, kot je prikazano na desni. Raztopino metil benzoata vnašamo po kapljicah v desetih minutah, pri čemer hladimo le toliko, kolikor je potrebno za nadzor eksotermne reakcije. Produktna sol se v tej fazi loči kot bela trdna snov. Bučko v rednih časovnih presledkih vrtimo, dokler reakcija ne popusti in je temperatura bučke na sobni temperaturi. Pojditeneposredno na naslednji korak.
Hidroliza produkta adicije.
Hidroliza produkta adicije.
Reakcijsko zmes previdno prelijte v 250-mililitrsko Erlenmeyerjevo bučko, ki vsebuje 50 ml 10-odstotne žveplove kisline in približno 25 g ledu. Za izpiranje reakcijske bučke uporabite nekaj ml navadnega (brezvodnega) etra in nekaj ml 10-odstotne žveplove kisline. Ta izpiranja dodajte v Erlenmeyerjevo bučko. Dobro zavrtite, da pospešite hidrolizo adicijske spojine; osnovne magnezijeve soli se pretvorijo v vodotopne nevtralne soli, trifenilkarbinol pa se porazdeli v etrski sloj. Morda bo potrebna dodatna količina etra (navadnega), če je prvotna plast etra zaradi izhlapevanja postala prenizka. Na tej točki se lahko ustavite, če nimate dovolj časa za dokončanje naslednjega dela. Označen Erlenmeyerjev erlenmajer shranite v nape z rahlo pritrjenim plutovinastim (ne gumijastim) zamaškom. Zamašek mora biti dovolj ohlapen, da se bo sprostil morebitni plinski tlak zaradi izločanja vodikovega plina.
Ko pride neporabljena kovina Mg v stik s kislino, bo prišlo do močnega izločanja vodikovega plina in reakcijska zmes se lahko speni, če je dodajanje prehitro.
Izolacija produkta.
Če ima vaša etrska plast trdne bele kristale, so to kristali produkta, ki so nastali, ker je nekaj etrske plasti izhlapelo. Te kristale lahko izoliramo tako, da zmes vlijemo v ločevalni lijak skozi steklen lijak z majhnim čepom iz steklene volne v peclju. Kristale speremo z majhno količino etrskega topila. Za izolacijo preostalega produkta sperite Erlenmeyerjevo bučko, iz katere ste izlili prvotno raztopino, z nekaj ml navadnega etra in jo dodajte v ločevalni lijak. Lijak pretresite, pri čemer pazljivo poskrbite, da izpustite plin, ki se nabira v lijaku. Odstranite vodno plast. Etersko plast pretresemo z 10-odstotno žveplovo kislino, da dodatno odstranimo magnezijeve soli, in odstranimo plast žveplove kisline. Etersko plast speremo z nasičeno raztopino natrijevega klorida, da odstranimo vodo, ki se je raztopila v etru. Odstranite raztopino natrijevega klorida. Količine tekočine, uporabljene pri teh pranjih, niso bistvene. Na splošno zadostuje količina pralne tekočine, ki je enaka eni tretjini prostornine etra. Za dokončno sušenje etrske raztopine se etrska plast iz vratu ločevalnega lijaka prelije v Erlenmeyerjevo bučko, doda se približno 5 g zrnatega brezvodnega natrijevega sulfata, bučka se občasno zavrti in po 5 minutah se eter iz trdnega sušila dekantira v drugo čisto, suho Erlenmeyerjevo bučko. Eterni raztopini dodamo 25 ml ligroina in erlenmajerico zamašimo s plutovinastim zamaškom. Mešanico pustite stati čez noč ali do naslednjega laboratorijskega obdobja. Po mirovanju se morajo oblikovati kristali trifenilkarbinola. Glavna nečistota bifenil mora ostati topna v topilu za rekristalizacijo. Kristale filtrirajte s sesalno filtracijo, dokler niso suhi. Zapišite maso izoliranega produkta in izračunajte % izkoristka. Določite temperaturo taljenja.
Ko pride neporabljena kovina Mg v stik s kislino, bo prišlo do močnega izločanja vodikovega plina in reakcijska zmes se lahko speni, če je dodajanje prehitro.
Izolacija produkta.
Če ima vaša etrska plast trdne bele kristale, so to kristali produkta, ki so nastali, ker je nekaj etrske plasti izhlapelo. Te kristale lahko izoliramo tako, da zmes vlijemo v ločevalni lijak skozi steklen lijak z majhnim čepom iz steklene volne v peclju. Kristale speremo z majhno količino etrskega topila. Za izolacijo preostalega produkta sperite Erlenmeyerjevo bučko, iz katere ste izlili prvotno raztopino, z nekaj ml navadnega etra in jo dodajte v ločevalni lijak. Lijak pretresite, pri čemer pazljivo poskrbite, da izpustite plin, ki se nabira v lijaku. Odstranite vodno plast. Etersko plast pretresemo z 10-odstotno žveplovo kislino, da dodatno odstranimo magnezijeve soli, in odstranimo plast žveplove kisline. Etersko plast speremo z nasičeno raztopino natrijevega klorida, da odstranimo vodo, ki se je raztopila v etru. Odstranite raztopino natrijevega klorida. Količine tekočine, uporabljene pri teh pranjih, niso bistvene. Na splošno zadostuje količina pralne tekočine, ki je enaka eni tretjini prostornine etra. Za dokončno sušenje etrske raztopine se etrska plast iz vratu ločevalnega lijaka prelije v Erlenmeyerjevo bučko, doda se približno 5 g zrnatega brezvodnega natrijevega sulfata, bučka se občasno zavrti in po 5 minutah se eter iz trdnega sušila dekantira v drugo čisto, suho Erlenmeyerjevo bučko. Eterni raztopini dodamo 25 ml ligroina in erlenmajerico zamašimo s plutovinastim zamaškom. Mešanico pustite stati čez noč ali do naslednjega laboratorijskega obdobja. Po mirovanju se morajo oblikovati kristali trifenilkarbinola. Glavna nečistota bifenil mora ostati topna v topilu za rekristalizacijo. Kristale filtrirajte s sesalno filtracijo, dokler niso suhi. Zapišite maso izoliranega produkta in izračunajte % izkoristka. Določite temperaturo taljenja.
Sinteze psihoaktivnih snovi z Grignardovim reagentom.
Grignardov reagent se uporablja pri sintezi več površinsko aktivnih snovi. Na primer v sintezi sintetičnih kanabinoidov za priključitev alkilne skupine na dušikov atom indola (glejte primer sinteze JWH-018 ). Reakcija poteka dokaj hitro pod blagimi pogoji in je ni treba segrevati.
Nukleofilno dodajanje Grignardovega reagenta omogoča nekatere nespecifične in stereospecifične reakcije za nastanek amfetamina in njegovega predhodnika, kot je fenil-2-propanon (P2P).
Druga metoda uporabe Grignardovega reagenta je uporaba pri sintezi mefedrona (4-MMC) z uporabo 4-metilbenzaldehida kot izhodne snovi.
Reakcija indolilmagnezijevega jodida s substituiranimi alkil halidi, npr. nitrili Cl(CH2)nCN in kloroacetil dietilamidom, za pridobitev ustreznih 3-substituiranih indolov je dobro znana, čeprav zelo reaktivni halogenidi, kot sta metil jodid in benzil klorid, včasih dajejo 1,3-disubstituirane indole. Ta pot DMT je mogoča s pomočjo Grignardovega reagenta.
Polegprejšnjih različnih uporab se ta priljubljeni pristop uporablja v koraku sinteze ketamina priproizvodnji (o-klorofenil)-ciklopentil ketona.
Zaključek.
Kot lahko vidite, se Grignardov reagent pogosto uporablja pri organskih sintezah in proizvodnji zdravil. Alkil magnezijevi halogenidi (imenovani tudi Grignardovi reagenti) delujejo kot nukleofili in napadajo elektrofilni ogljikov atom, da bi tvorili vez med ogljikom in ogljikom. Grignardova reakcija je pomembna metoda za ustvarjanje vezi ogljik-ogljik in vezi ogljik-heteroatom. Ta seznam najbolj priljubljenih reakcij med tajnimi kemiki kaže ogromen potencial za uporabo Grignardovih reagentov in predstavlja veliko področje za raziskave.
Last edited:
