@G.Patton Jag tror att en av de ritade mellanprodukterna på denna syntes (och från den ursprungliga rodiumartikeln) är felaktig.
(3), representationen av mellanprodukten amfetamin-formaldehydimin har samma struktur som fenylaceton-metylaminiminen som kan ses någon annanstans
detta verkar inte korrekt för mig av två skäl: för det första, att dra standardmekanismen för iminbildning på substratet ger en imin där dubbelbindningen är mellan N och den blivande metylgruppen på metamfetaminet, och INTE mellan N och alfa-kolet som i den angivna strukturen. och tänk på det: dubbelbindningen genereras när aminens lonepar sparkar av vattnet som bildas på formaldehydsyre som en avgående grupp, vilket måste göras på formaldehydsidan (den blivande metylgruppen)
för det andra rapporteras syntesen som stereospecifik baserat på utgångssubstratet. det vill säga reduktionen av d-amf kommer att ge d-meth och detsamma för l-isomeren. strukturen som visas (3) har inga kirala centra, och dess reduktion motsvarar den standardreducerande amineringen av fenylaceton som ger en racemisk produkt. den föreslagna strukturen jag har gett för mellanprodukten har ett kiralt centrum, vilket skulle vara detsamma som utgångsmaterialets och därför matcha den observerade stereospecificiteten hos reaktionen.
om jag har rätt, skulle detta klargöra frågorna om reaktionens stereospecificitet tidigare i tråden. om jag har gjort ett misstag någonstans, ber jag om ursäkt, men jag var nyfiken på varför reduktionen av den icke-kirala (3) leder till en icke-rakemisk blandning av produkter när ett icke-rakemiskt amfetamin utgångsmaterial används.
(3), representationen av mellanprodukten amfetamin-formaldehydimin har samma struktur som fenylaceton-metylaminiminen som kan ses någon annanstans
detta verkar inte korrekt för mig av två skäl: för det första, att dra standardmekanismen för iminbildning på substratet ger en imin där dubbelbindningen är mellan N och den blivande metylgruppen på metamfetaminet, och INTE mellan N och alfa-kolet som i den angivna strukturen. och tänk på det: dubbelbindningen genereras när aminens lonepar sparkar av vattnet som bildas på formaldehydsyre som en avgående grupp, vilket måste göras på formaldehydsidan (den blivande metylgruppen)
för det andra rapporteras syntesen som stereospecifik baserat på utgångssubstratet. det vill säga reduktionen av d-amf kommer att ge d-meth och detsamma för l-isomeren. strukturen som visas (3) har inga kirala centra, och dess reduktion motsvarar den standardreducerande amineringen av fenylaceton som ger en racemisk produkt. den föreslagna strukturen jag har gett för mellanprodukten har ett kiralt centrum, vilket skulle vara detsamma som utgångsmaterialets och därför matcha den observerade stereospecificiteten hos reaktionen.
om jag har rätt, skulle detta klargöra frågorna om reaktionens stereospecificitet tidigare i tråden. om jag har gjort ett misstag någonstans, ber jag om ursäkt, men jag var nyfiken på varför reduktionen av den icke-kirala (3) leder till en icke-rakemisk blandning av produkter när ett icke-rakemiskt amfetamin utgångsmaterial används.
- Joined
- Jul 5, 2021
- Messages
- 3,323
- Solutions
- 3
- Reaction score
- 3,807
- Points
- 113
- Deals
- 1
Hej. För det första har a-kol mer elektrontäthet än metylkol. Typisk mekanism leder till sådan mellanliggande (dold under Breaking Bad vattenstämpel, sry):
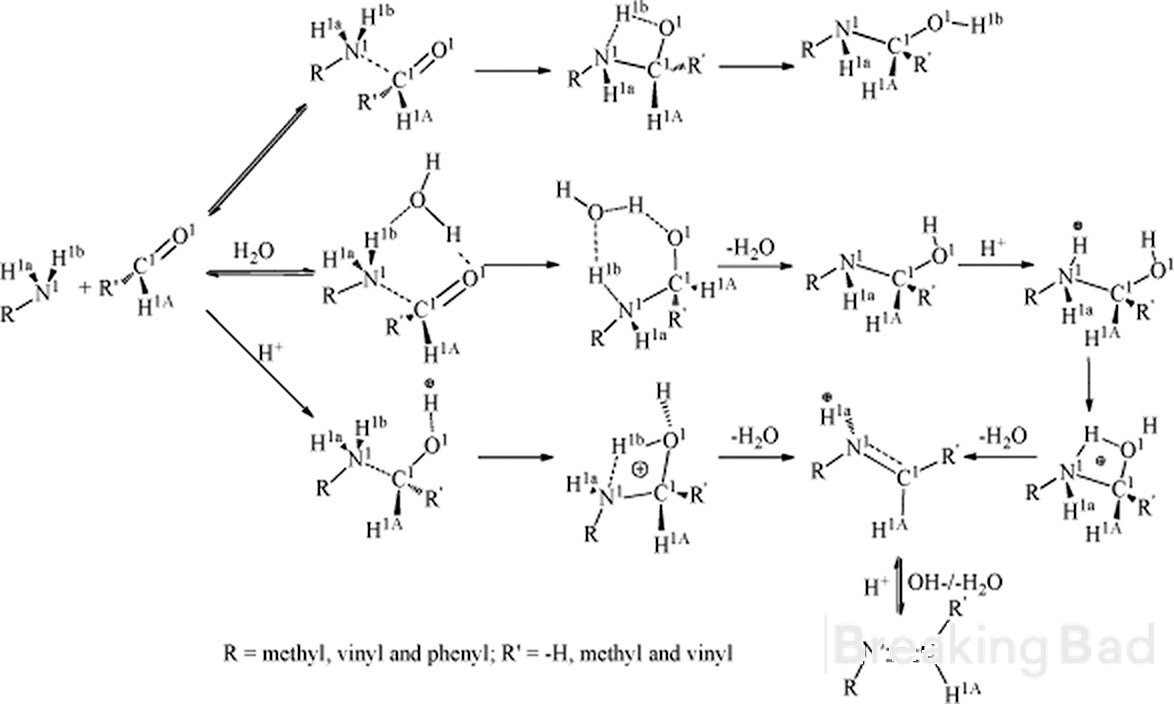
För det andra, har du några tillförlitliga uppgifter om stereospecifikt resultat av denna syntes?
För det andra, har du några tillförlitliga uppgifter om stereospecifikt resultat av denna syntes?
↑View previous replies…
NexusPrime
Don't buy from me
- Language
- 🇷🇺
- Joined
- Apr 2, 2024
- Messages
- 3
- Reaction score
- 0
- Points
- 1
- By NexusPrime
rhodium är ett misstag, dubbelbindningen finns inte där, se exemplet med bensaldehyd nedan
