@G.Patton Ma usun, et üks selle sünteesi (ja algse roodiumiartikli) joonistatud vaheühendustest on vale.
(3), amfetamiin-formaldehüüdi imiini vaheühendi kujutis omab sama struktuuri kui fenüülatsetoon-metüülamiini imiin, mida võib näha mujalgi
see ei tundu mulle õige kahel põhjusel: esiteks, joonistades imiini moodustumise standardmehhanismi substraadil, tekib imiin, milles kaksikside on N ja metüülrühmaks pidava metüülrühma vahel metamfetamiinil, mitte aga N ja alfa-süsiniku vahel nagu loetletud struktuuris. ja mõelge järele: kaksikside tekib, kui amiini üksikpaar lööb formaldehüüdi hapnikul moodustatud vee kui lahkumisrühma välja, mis peab toimuma formaldehüüdi (metüülrühmaks pidava) poolel.
teiseks, süntees on teatatud stereospetsiifiliseks lähtesubstraadi alusel. st d-amfi redutseerimisel saadakse d-meth ja sama ka l-isomeeri puhul. struktuur, nagu on näidatud (3), ei oma kiraalseid keskusi ja selle redutseerimine on samaväärne fenüülatsetooni standardse reduktiivse aminatsiooniga, mille tulemuseks on rassemiline toode. minu poolt esitatud vaheproduktide kavandatud struktuur omab kiraalset keskust, mis oleks sama, mis lähtematerjalil, ja seega vastaks reaktsiooni täheldatud stereospetsiifilisusele.
kui mul on õigus, siis see klaariks teemas varem esitatud küsimused seoses reaktsiooni stereospetsiifilisusega. kui ma olen kuskil viga teinud, siis palun vabandust, kuid mind huvitas, miks mitte-kiraalse (3) redutseerimine viib mitte-rakkeemilise segu produktideni, kui kasutatakse mitte-rakkeemilist amfetamiini lähtematerjali.
(3), amfetamiin-formaldehüüdi imiini vaheühendi kujutis omab sama struktuuri kui fenüülatsetoon-metüülamiini imiin, mida võib näha mujalgi
see ei tundu mulle õige kahel põhjusel: esiteks, joonistades imiini moodustumise standardmehhanismi substraadil, tekib imiin, milles kaksikside on N ja metüülrühmaks pidava metüülrühma vahel metamfetamiinil, mitte aga N ja alfa-süsiniku vahel nagu loetletud struktuuris. ja mõelge järele: kaksikside tekib, kui amiini üksikpaar lööb formaldehüüdi hapnikul moodustatud vee kui lahkumisrühma välja, mis peab toimuma formaldehüüdi (metüülrühmaks pidava) poolel.
teiseks, süntees on teatatud stereospetsiifiliseks lähtesubstraadi alusel. st d-amfi redutseerimisel saadakse d-meth ja sama ka l-isomeeri puhul. struktuur, nagu on näidatud (3), ei oma kiraalseid keskusi ja selle redutseerimine on samaväärne fenüülatsetooni standardse reduktiivse aminatsiooniga, mille tulemuseks on rassemiline toode. minu poolt esitatud vaheproduktide kavandatud struktuur omab kiraalset keskust, mis oleks sama, mis lähtematerjalil, ja seega vastaks reaktsiooni täheldatud stereospetsiifilisusele.
kui mul on õigus, siis see klaariks teemas varem esitatud küsimused seoses reaktsiooni stereospetsiifilisusega. kui ma olen kuskil viga teinud, siis palun vabandust, kuid mind huvitas, miks mitte-kiraalse (3) redutseerimine viib mitte-rakkeemilise segu produktideni, kui kasutatakse mitte-rakkeemilist amfetamiini lähtematerjali.
Tere. Esiteks on a-süsinikul suurem elektrontihedus kui metüülsüsinikul. Tüüpiline mehhanism viib sellise vahepealse (peidetud Breaking Bad vesimärgi alla, sry):
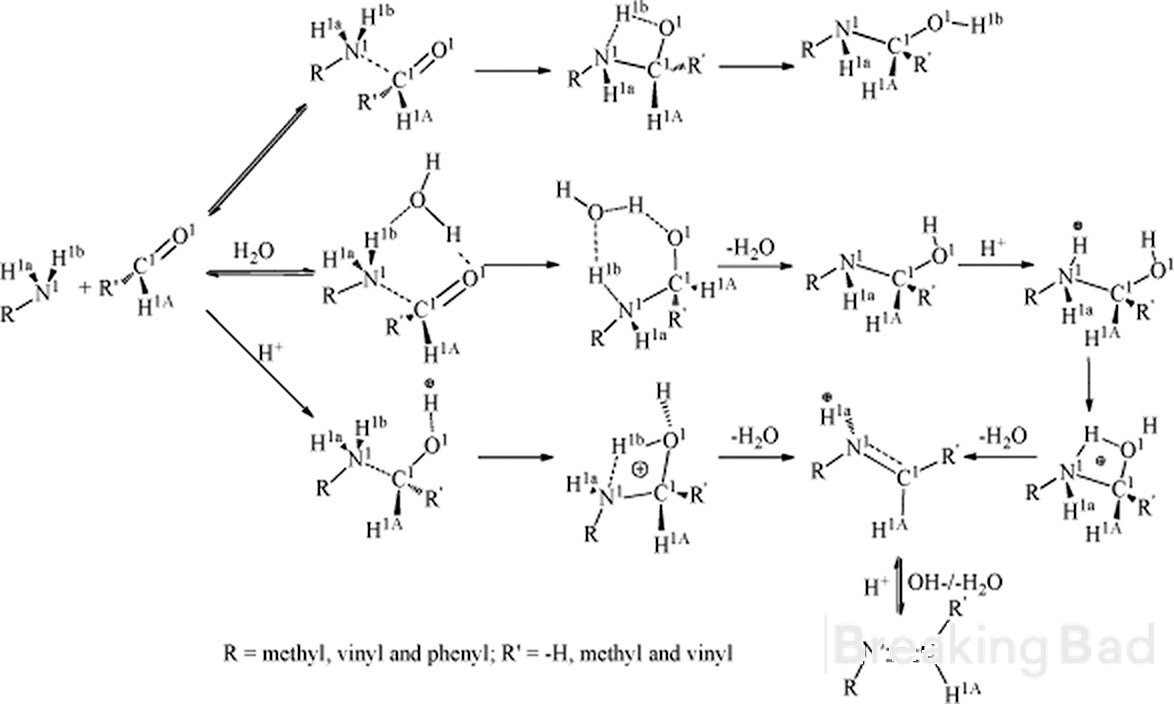
Teiseks, kas teil on mingeid usaldusväärseid andmeid selle sünteesi stereospetsiifilise tulemuse kohta?
Teiseks, kas teil on mingeid usaldusväärseid andmeid selle sünteesi stereospetsiifilise tulemuse kohta?
