@G.Patton Credo che uno degli intermedi disegnati in questa sintesi (e nell'articolo originale sul rodio) non sia corretto.
(3), la rappresentazione dell'intermedio anfetamina-formaldeide-imina possiede la stessa struttura della fenilacetone-metilammina-imina che si può vedere altrove.
questo non mi sembra corretto per due motivi: in primo luogo, disegnando il meccanismo standard per la formazione dell'immina sul substrato si ottiene un'immina in cui il doppio legame è tra N e l'aspirante gruppo metilico della metamfetamina, e NON tra N e l'alfa-carbonio come nella struttura elencata. e pensateci bene: il doppio legame si genera quando la coppia solitaria dell'ammina scalcia via l'acqua formatasi sull'ossigeno della formaldeide come gruppo di partenza, cosa che deve avvenire dalla parte della formaldeide (l'aspirante gruppo metilico)
in secondo luogo, la sintesi è riportata come stereospecifica in base al substrato di partenza. cioè, la riduzione di d-amph produrrà d-meth e lo stesso per l'l-isomero. la struttura così come è mostrata (3) non possiede centri chirali, e la sua riduzione è equivalente all'aminazione riduttiva standard del fenilacetone che dà un prodotto racemico. la struttura proposta che ho dato per l'intermedio possiede un centro chirale, che sarebbe lo stesso del materiale di partenza e quindi corrisponde alla stereospecificità osservata della reazione.
Se ho ragione, questo chiarirebbe le questioni riguardanti la stereospecificità della reazione in precedenza nel thread. se ho commesso un errore da qualche parte, mi scuso, ma ero curioso di sapere perché la riduzione della (3) non chirale porta a una miscela non racemica di prodotti quando si usa un materiale di partenza anfetaminico non racemico.
(3), la rappresentazione dell'intermedio anfetamina-formaldeide-imina possiede la stessa struttura della fenilacetone-metilammina-imina che si può vedere altrove.
questo non mi sembra corretto per due motivi: in primo luogo, disegnando il meccanismo standard per la formazione dell'immina sul substrato si ottiene un'immina in cui il doppio legame è tra N e l'aspirante gruppo metilico della metamfetamina, e NON tra N e l'alfa-carbonio come nella struttura elencata. e pensateci bene: il doppio legame si genera quando la coppia solitaria dell'ammina scalcia via l'acqua formatasi sull'ossigeno della formaldeide come gruppo di partenza, cosa che deve avvenire dalla parte della formaldeide (l'aspirante gruppo metilico)
in secondo luogo, la sintesi è riportata come stereospecifica in base al substrato di partenza. cioè, la riduzione di d-amph produrrà d-meth e lo stesso per l'l-isomero. la struttura così come è mostrata (3) non possiede centri chirali, e la sua riduzione è equivalente all'aminazione riduttiva standard del fenilacetone che dà un prodotto racemico. la struttura proposta che ho dato per l'intermedio possiede un centro chirale, che sarebbe lo stesso del materiale di partenza e quindi corrisponde alla stereospecificità osservata della reazione.
Se ho ragione, questo chiarirebbe le questioni riguardanti la stereospecificità della reazione in precedenza nel thread. se ho commesso un errore da qualche parte, mi scuso, ma ero curioso di sapere perché la riduzione della (3) non chirale porta a una miscela non racemica di prodotti quando si usa un materiale di partenza anfetaminico non racemico.
Salve, innanzitutto il carbonio a ha una densità di elettroni maggiore rispetto al carbonio metile. Il meccanismo tipico che porta a questo intermedio (nascosto sotto il watermark di Breaking Bad, sry):
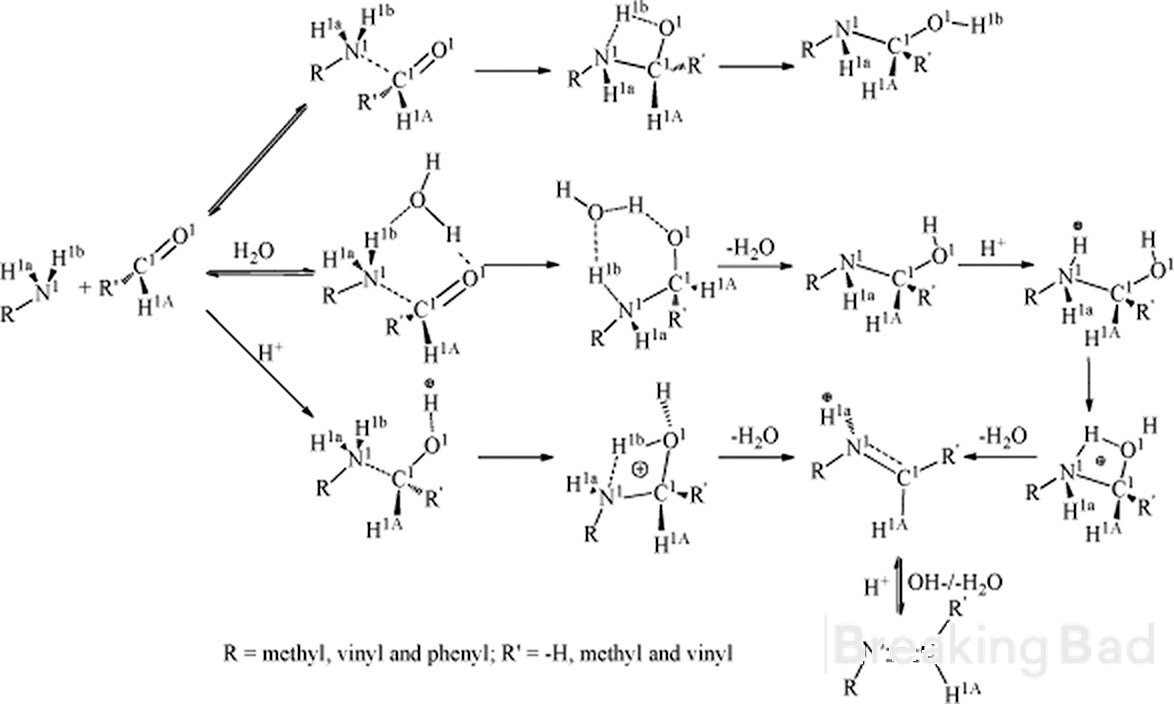
In secondo luogo, hai qualche dato affidabile sul risultato stereo-specifico di questa sintesi?
In secondo luogo, hai qualche dato affidabile sul risultato stereo-specifico di questa sintesi?
↑View previous replies…
- By NexusPrime
Il rodio è un errore, il doppio legame non c'è, vedere l'esempio con la benzaldeide qui sotto
