@G.Patton Uważam, że jeden z narysowanych półproduktów w tej syntezie (i z oryginalnego artykułu o rodzie) jest nieprawidłowy.
(3), reprezentacja półproduktu iminy amfetaminy-formaldehydu ma taką samą strukturę jak imina fenyloacetonu-metyloaminy, którą można zobaczyć gdzie indziej.
nie wydaje mi się to poprawne z dwóch powodów: po pierwsze, narysowanie standardowego mechanizmu tworzenia iminy na podłożu daje iminę, w której podwójne wiązanie znajduje się między N a niedoszłą grupą metylową na metamfetaminie, a NIE między N a węglem alfa, jak w wymienionej strukturze. i pomyśl o tym: podwójne wiązanie jest generowane, gdy samotna para aminy odrzuca wodę utworzoną na tlenie formaldehydu jako grupę opuszczającą, co musi być wykonane po stronie formaldehydu (niedoszła grupa metylowa).
Po drugie, synteza jest opisywana jako stereospecyficzna w oparciu o substrat wyjściowy. Oznacza to, że redukcja d-amf da d-met i to samo dla izomeru l. Struktura, jak pokazano (3), nie posiada centrów chiralnych, a jej redukcja jest równoważna standardowemu redukcyjnemu aminowaniu fenyloacetonu, które daje produkt racemiczny. proponowana struktura, którą podałem dla półproduktu, posiada centrum chiralne, które byłoby takie samo jak w materiale wyjściowym, a zatem pasowałoby do obserwowanej stereospecyficzności reakcji.
Jeśli mam rację, wyjaśniłoby to kwestie dotyczące stereospecyficzności reakcji wcześniej w wątku. Jeśli gdzieś popełniłem błąd, przepraszam, ale byłem ciekawy, dlaczego redukcja niechiralnej (3) prowadzi do nieracemicznej mieszaniny produktów, gdy używany jest nieracemiczny materiał wyjściowy amfetaminy.
(3), reprezentacja półproduktu iminy amfetaminy-formaldehydu ma taką samą strukturę jak imina fenyloacetonu-metyloaminy, którą można zobaczyć gdzie indziej.
nie wydaje mi się to poprawne z dwóch powodów: po pierwsze, narysowanie standardowego mechanizmu tworzenia iminy na podłożu daje iminę, w której podwójne wiązanie znajduje się między N a niedoszłą grupą metylową na metamfetaminie, a NIE między N a węglem alfa, jak w wymienionej strukturze. i pomyśl o tym: podwójne wiązanie jest generowane, gdy samotna para aminy odrzuca wodę utworzoną na tlenie formaldehydu jako grupę opuszczającą, co musi być wykonane po stronie formaldehydu (niedoszła grupa metylowa).
Po drugie, synteza jest opisywana jako stereospecyficzna w oparciu o substrat wyjściowy. Oznacza to, że redukcja d-amf da d-met i to samo dla izomeru l. Struktura, jak pokazano (3), nie posiada centrów chiralnych, a jej redukcja jest równoważna standardowemu redukcyjnemu aminowaniu fenyloacetonu, które daje produkt racemiczny. proponowana struktura, którą podałem dla półproduktu, posiada centrum chiralne, które byłoby takie samo jak w materiale wyjściowym, a zatem pasowałoby do obserwowanej stereospecyficzności reakcji.
Jeśli mam rację, wyjaśniłoby to kwestie dotyczące stereospecyficzności reakcji wcześniej w wątku. Jeśli gdzieś popełniłem błąd, przepraszam, ale byłem ciekawy, dlaczego redukcja niechiralnej (3) prowadzi do nieracemicznej mieszaniny produktów, gdy używany jest nieracemiczny materiał wyjściowy amfetaminy.
Witam. Po pierwsze, węgiel a ma większą gęstość elektronową niż węgiel metylowy. Typowy mechanizm prowadzący do takiego związku pośredniego (ukryty pod znakiem wodnym Breaking Bad, sry):
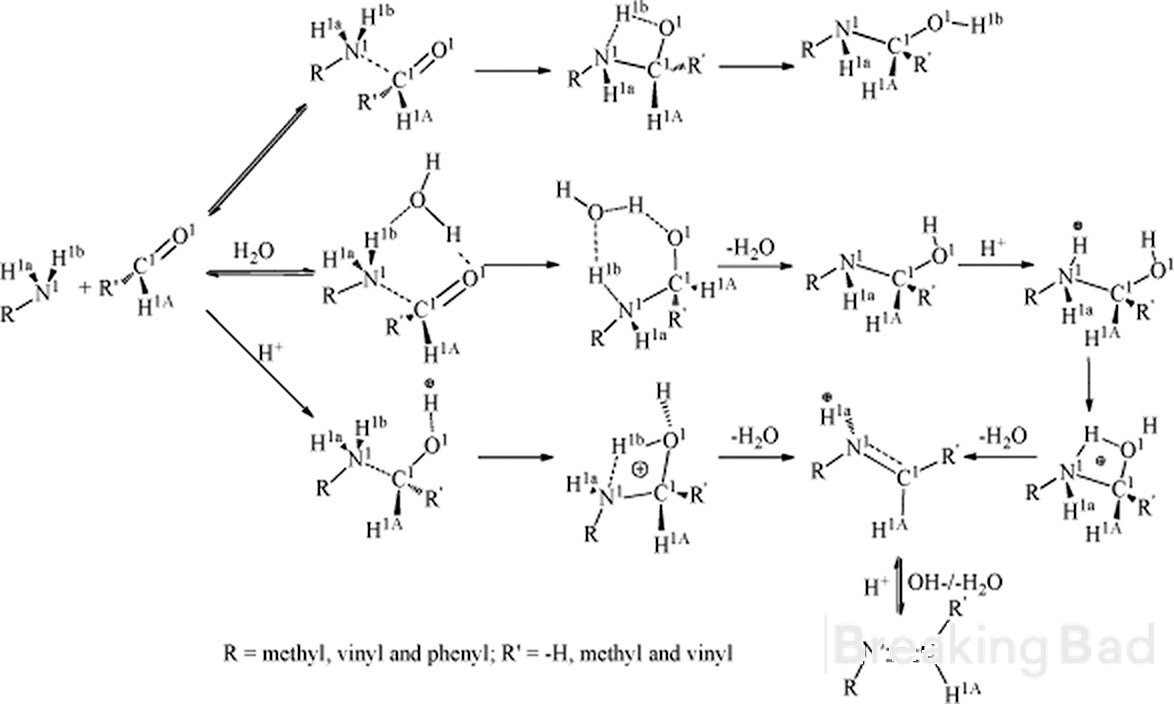
Po drugie, czy masz jakieś wiarygodne dane na temat stereospecyficznego wyniku tej syntezy?
Po drugie, czy masz jakieś wiarygodne dane na temat stereospecyficznego wyniku tej syntezy?
↑View previous replies…
- By NexusPrime
Rod jest błędem, podwójne wiązanie nie występuje, patrz przykład z benzaldehydem poniżej.
