G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,951
- Solutions
- 3
- Reaction score
- 3,318
- Points
- 113
- Deals
- 1
Reacções com reagentes de Grignard.
Um reagente de Grignard tem uma fórmula RMgX em que X é um halogéneo e R é um grupo alquilo ou arilo (baseado num anel de benzeno). Para efeitos deste tópico, consideraremos R como um grupo alquilo (por exemplo, BuMgBr). Os reagentes de Grignard são obtidos adicionando o halogenoalcano a pequenos pedaços de magnésio num balão com éter dietílico. O balão é equipado com um condensador de refluxo e a mistura é aquecida num banho de água durante 20 a 30 minutos.
Tudo deve estar perfeitamente seco, pois os reagentes de Grignard reagem com a água (ver abaixo). Todas as reacções que utilizam o reagente de Grignard são realizadas com a mistura produzida a partir desta reação. Não épossível separá-la de forma alguma.
Reagentes de Grignard e água.
Os reagentes de Grignard reagem com a água para produzir alcanos. Esta é a razão pela qual tudo tem de estar muito seco durante a preparação acima referida. Por exemplo:O produto inorgânico, Mg(OH)Br, é referido como um "brometo básico" e é uma espécie de meio-termo entre o brometo de magnésio e o hidróxido de magnésio.
Reação geral entre Grignards e carbonilos.
As reacções entre os vários tipos de compostos carbonílicos e os reagentes de Grignard podem parecer bastante complicadas, mas na realidade reagem todas da mesma forma - tudo o que muda são os grupos ligados à dupla ligação carbono-oxigénio. É muito mais fácil compreender o que se passa se olharmos atentamente para o caso geral (utilizando grupos "R" em vez de grupos específicos) - e depois inserirmos os vários grupos reais como e quando for necessário.
As reacções são essencialmente idênticas à reação com dióxido de carbono - tudo o que difere é a natureza do produto orgânico. Na primeira fase, o reagente de Grignard adiciona a ligação dupla carbono-oxigénio.
As reacções são essencialmente idênticas à reação com dióxido de carbono - tudo o que difere é a natureza do produto orgânico. Na primeira fase, o reagente de Grignard adiciona a ligação dupla carbono-oxigénio.
Em seguida, adiciona-se ácido diluído para hidrolisar o produto. (Estou a utilizar a equação normalmente aceite, ignorando o facto de o Mg(OH)Br reagir ainda mais com o ácido).
Forma-se um álcool. Uma das principais utilizações dos reagentes de Grignard é a capacidade de produzir facilmente álcoois complicados. O tipo de álcool que se obtém depende do composto carbonílico com que se começou - por outras palavras, quais são R e R'.
Os reagentes de Grignard são amplamente utilizados para a síntese de várias classes de compostos orgânicos. Apresentam-se de seguida alguns exemplos.
Reacções
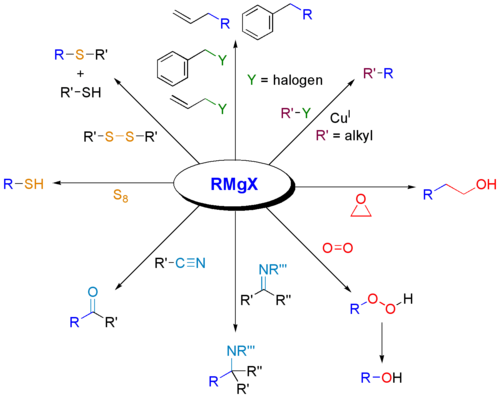
Porque é que os reagentes de Grignard reagem com carbonilos?
A ligação entre o átomo de carbono e o magnésio é polar. O carbono é mais eletronegativo do que o magnésio, pelo que o par de electrões da ligação é puxado para o carbono. Isto deixa o átomo de carbono com uma ligeira carga negativa.
A ligação dupla carbono-oxigénio é também altamente polar, com uma quantidade significativa de carga positiva no átomo de carbono. O reagente de Grignard pode, portanto, servir como nucleófilo devido à atração entre a ligeira negatividade do átomo de carbono no reagente de Grignard e a positividade do carbono no composto carbonílico. Um nucleófilo é um átomo negativo (ou ligeiramente negativo) que ataca centros positivos (ou ligeiramente positivos) de outras moléculas ou iões.
Preparação do reagente de Grignard, brometo de fenilmagnésio.
Os reagentes de Grignard desempenham um papel preponderante na síntese orgânica. Estes compostos podem ser adaptados à preparação de uma grande variedade de grupos funcionais, e a formação e reação de derivados de organomagnésio são uma das principais utilizações dos halogenetos de alquilo na síntese orgânica. A reação de um halogeneto e magnésio ocorre na superfície do metal e é formalmente uma oxidação do metal. A reação é geralmente realizada em solvente de éter seco, funcionando o éter como uma base de Lewis ao solvatar o reagente de Grignard e ao permitir a sua difusão para longe do metal. A formação do reagente organometálico requer uma superfície ativa no metal, podendo haver alguma dificuldade em iniciar a reação devido à presença de óxidos metálicos na superfície do metal. A trituração do magnésio num almofariz durante alguns minutos antes da utilização é frequentemente eficaz para obter uma superfície limpa. Outro truque útil para iniciar uma reação é a adição de um pequeno cristal de iodo à mistura, que reage com o magnésio para formar o sal muito reativo iodeto de magnésio (MgI2).
Procedimento.
Para preparar o reagente de Grignard, começa-se por equipar um balão de fundo redondo de 250 ml seco com um tubo de secagem de CaCl2. Coloca-se no balão o magnésio a utilizar (2 g = 0,082 moles de tornas de magnésio), liga-se diretamente o tubo de cloreto de cálcio e aquece-se bem o balão com uma grande manta de aquecimento e um reóstato. Regular o regulador de uma grande manta de aquecimento para a posição "6" e aquecer o balão até ficar demasiado quente para tocar com o dedo. Ao arrefecer, o balão acumula ar seco através do cloreto de cálcio. Retirar a manta de aquecimento e arrefecer até à temperatura ambiente (o frasco deve estar ligeiramente quente na mão, ou mais frio) antes de prosseguir. Retirar o tubo de secagem do cloreto de cálcio e deitar no balão de fundo redondo de 250 ml 15 ml de éter absoluto e 9 ml (13,5 g = 0,086 moles) de bromobenzeno. Voltar a colocar o tubo de secagem de CaCl2. Se não houver sinais imediatos de reação, iniciar a reação esmagando algumas das aparas de magnésio. Para o efeito, introduzir uma vareta de agitação seca com a extremidade achatada e esmagar cuidadosamente um pedaço de magnésio contra o fundo do balão, sob a superfície do líquido, dando um movimento de torção à vareta. Quando isto é feito corretamente, o líquido torna-se ligeiramente turvo e começa a borbulhar rapidamente à superfície do metal comprimido. Nesta altura,juntar mais 25 ml de éter absoluto e colocar um condensador de refluxo no balão e o tubo de CaCl2 no topo do condensador de refluxo, como se mostra na figura.
Só começar a passar água pelo condensador quando os vapores de éter tiverem molhado a junta no topo do condensador. Quando necessário, arrefecer o balão tocando no fundo do balão com um banho de gelo para retardar a reação, mas não o utilizar a menos que seja necessário. Só é necessário se os vapores de éter estiverem a sair do topo do tubo de secagem. Se tiver de arrefecer a reação, tenha cuidado para não abrandar demasiado a reação, ou esta pode parar e não recomeçar quando o gelo for retirado. Agitar vigorosamente o balão de sessenta em sessenta segundos. Uma vez iniciada a reação, a ebulição espontânea na mistura diluída pode ser lenta ou tornar-se lenta. Neste caso, adicionar mais alguns ml de bromobenzeno ao balão. A reação está completa quando o éter deixar de borbulhar e restarem apenas alguns pequenos restos de metal. Marcar o nível de éter no balão. Durante a reação, verificar se o volume de éter não diminuiu. Se o volume tiver diminuído, adicionar mais éter seco. Dado que a solução do reagente de Grignard se deteriora com o tempo, a etapa seguinte deve ser iniciada imediatamente.
Condensação do reagente de Grignard com benzoato de metilo.
Condensação do reagente de Grignard com benzoato de metilo.
Misturar 5 g (0,037 mole; 1,09 g/ml) de benzoato de metilo e 15 ml de éter absoluto numa ampola de decantação, arrefecer brevemente o balão que contém a solução de reagente de Grignard num banho de gelo. Retirar o tubo de secagem e inserir um adaptador de Claisen e uma ampola de decantação na parte superior do condensador, como se mostra à direita. Introduzir a solução de benzoato de metilo gota a gota, durante um período de dez minutos, apenas com o arrefecimento necessário para controlar a reação exotérmica. O produto salino separa-se como um sólido branco durante este passo. Agitar o balão a intervalos regulares até que a reação tenha diminuído e o balão esteja à temperatura ambiente. Passar diretamente à etapa seguinte.
Hidrólise do produto de adição.
Hidrólise do produto de adição.
Verter cuidadosamente a mistura reacional para um Erlenmeyer de 250 ml contendo 50 ml de ácido sulfúrico a 10% e cerca de 25 g de gelo. Utilizar alguns ml de éter comum (não anidro) e alguns ml de ácido sulfúrico a 10% para lavar o balão de reação. Adicionar estas lavagens ao Erlenmeyer. Agitar bem para promover a hidrólise do composto de adição; os sais básicos de magnésio são convertidos em sais neutros solúveis em água e o trifenilcarbinol é distribuído na camada de éter. Pode ser necessária uma quantidade adicional de éter (normal) se a camada de éter original se tiver tornado demasiado baixa devido à evaporação. Pode parar neste ponto se não houver tempo suficiente para completar a parte seguinte. Guardar o Erlenmeyer rotulado na campânula com uma rolha de cortiça (não de borracha) ligeiramente ajustada. A rolha deve estar suficientemente solta para que a pressão do gás de hidrogénio em evolução seja libertada.
Quando o Mg metálico não consumido entra em contacto com o ácido, haverá uma evolução vigorosa do gás de hidrogénio e a mistura reacional pode espumar se a adição for demasiado rápida.
Isolamento do produto.
Se a sua camada de éter tiver cristais brancos sólidos, estes cristais de produto formaram-se porque alguma camada de éter evaporou. Estes cristais podem ser isolados deitando a mistura numa ampola de decantação através de um funil de vidro com um pequeno tampão de lã de vidro na haste. Lavar os cristais com uma pequena quantidade de solvente de éter. Para isolar o produto remanescente, lavar o Erlenmeyer, do qual se verteu a solução original, com alguns ml de éter comum e adicioná-lo à ampola de decantação. Agitar a ampola de decantação, tendo o cuidado de ventilar a acumulação de gás na ampola. Retirar a camada aquosa. Agitar a camada de éter com ácido sulfúrico a 10% para remover ainda mais os sais de magnésio e retirar a camada de ácido sulfúrico. Lavar a camada de éter com solução saturada de cloreto de sódio para remover a água que se dissolveu no éter. Remover a solução de cloreto de sódio. As quantidades de líquido utilizadas nestas operações de lavagem não são críticas. Em geral, é suficiente uma quantidade de líquido de lavagem igual a um terço do volume de éter. Para efetuar a secagem final da solução de éter, verter a camada de éter do gargalo da ampola de decantação para um Erlenmeyer, adicionar cerca de 5 g de sulfato de sódio anidro granular, agitar o balão de vez em quando e, após 5 minutos, decantar o éter do agente secante sólido para outro Erlenmeyer limpo e seco. Adicionar 25 ml de ligroína à solução etérea e tapar o balão com uma rolha de cortiça. Deixar a mistura repousar durante a noite ou até ao período laboratorial seguinte. Após o repouso, devem ter-se formado cristais de trifenilcarbinol. A impureza principal, o bifenilo, deve permanecer solúvel no solvente de recristalização. Filtrar os cristais por filtração por sucção até ficarem secos. Registar o peso do produto isolado e calcular a % de rendimento. Determinar oponto de fusão.
Quando o Mg metálico não consumido entra em contacto com o ácido, haverá uma evolução vigorosa do gás de hidrogénio e a mistura reacional pode espumar se a adição for demasiado rápida.
Isolamento do produto.
Se a sua camada de éter tiver cristais brancos sólidos, estes cristais de produto formaram-se porque alguma camada de éter evaporou. Estes cristais podem ser isolados deitando a mistura numa ampola de decantação através de um funil de vidro com um pequeno tampão de lã de vidro na haste. Lavar os cristais com uma pequena quantidade de solvente de éter. Para isolar o produto remanescente, lavar o Erlenmeyer, do qual se verteu a solução original, com alguns ml de éter comum e adicioná-lo à ampola de decantação. Agitar a ampola de decantação, tendo o cuidado de ventilar a acumulação de gás na ampola. Retirar a camada aquosa. Agitar a camada de éter com ácido sulfúrico a 10% para remover ainda mais os sais de magnésio e retirar a camada de ácido sulfúrico. Lavar a camada de éter com solução saturada de cloreto de sódio para remover a água que se dissolveu no éter. Remover a solução de cloreto de sódio. As quantidades de líquido utilizadas nestas operações de lavagem não são críticas. Em geral, é suficiente uma quantidade de líquido de lavagem igual a um terço do volume de éter. Para efetuar a secagem final da solução de éter, verter a camada de éter do gargalo da ampola de decantação para um Erlenmeyer, adicionar cerca de 5 g de sulfato de sódio anidro granular, agitar o balão de vez em quando e, após 5 minutos, decantar o éter do agente secante sólido para outro Erlenmeyer limpo e seco. Adicionar 25 ml de ligroína à solução etérea e tapar o balão com uma rolha de cortiça. Deixar a mistura repousar durante a noite ou até ao período laboratorial seguinte. Após o repouso, devem ter-se formado cristais de trifenilcarbinol. A impureza principal, o bifenilo, deve permanecer solúvel no solvente de recristalização. Filtrar os cristais por filtração por sucção até ficarem secos. Registar o peso do produto isolado e calcular a % de rendimento. Determinar oponto de fusão.
Síntese de substâncias psicoactivas com o reagente de Grignard.
O reagente de Grignard é utilizado na síntese de vários tensioactivos. Por exemplo, na síntese de canabinóides sintéticos para a ligação de um grupo alquilo ao átomo de azoto do indol (ver exemplo da síntese do JWH-018 ). A reação processa-se muito rapidamente em condições suaves e não requer aquecimento.
A adição nucleofílica do reagente de Grignard permite uma reação não específica e estereoespecífica para produzir anfetamina e o seu precursor, como a fenil-2-propanona (P2P).
Outro método de aplicação do reagente de Grignard é a sua utilização na síntese da mefedrona (4-MMC), utilizando o 4-metilbenzaldeído como material de partida.
A reação do iodeto de indolilmagnésio com halogenetos de alquilo substituídos, por exemplo, as nitrilas Cl(CH2)nCN e a dietilamida de cloroacetilo, para dar os correspondentes indóis 3-substituídos é bem conhecida, embora halogenetos muito reactivos, como o iodeto de metilo e o cloreto de benzilo, dêem por vezes indóis 1,3-dissubstituídos. Esta via DMT épossível com a ajuda do reagente de Grignard.
Paraalém da variedade de aplicações anteriores, esta abordagem popular é utilizada na etapa de síntese da cetamina do fabrico da (o-clorofenil)-ciclopentilcetona.
Conclusão.
Como se pode ver, o reagente de Grignard é utilizado extensivamente em sínteses orgânicas e no fabrico de medicamentos, em parte. Os halogenetos de alquil magnésio (também chamados reagentes de Grignard) actuam como nucleófilos, atacando um átomo de carbono electrofílico para formar uma ligação carbono-carbono. A reação de Grignard é um método importante para criar ligações carbono-carbono, bem como ligações carbono-heteroátomo. Esta lista das reacções mais populares entre os químicos clandestinos mostra o enorme potencial das aplicações dos reagentes de Grignard e constitui um vasto campo de investigação.
Last edited:
