G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,991
- Solutions
- 3
- Reaction score
- 3,378
- Points
- 113
- Deals
- 1
Introducere
Eterul dietilic, sau CH3CH2-O-CH2CH3 (Et2O), este un solvent excelent pentru multe reacții, dar este extrem de inflamabil. Chimiștii profesioniști sunt bine informați cu privire la pericolele prezentate de utilizarea eterului, dar este mai puțin probabil ca profanul să fie conștient de aceste pericole. Vaporii de eter dietilic în aer uscat pot forma peroxizi explozivi. Cu alte cuvinte, chiar și într-un mediu fără scântei/ flăcări, se pot produce explozii atunci când se întâlnesc vapori de eter. Din acest motiv, ar trebui să existe o modalitate de îndepărtare a vaporilor din vecinătate (o hotă ar fi un bun exemplu) și nu ar trebui să se utilizeze eter în zilele cu umiditate extrem de scăzută. Deoarece eterul dietilic este atât de inflamabil și predispus la aprindere, această procedură trebuie efectuată cu ajutorul unui încălzitor/agitator proiectat pentru utilizarea în medii inflamabile. Un astfel de încălzitor/agitator nu produce o scânteie de contact atunci când este pornită placa de încălzire și, în general, utilizează un motor de curent alternativ fără perii pentru agitator, deoarece motoarele de curent continuu cu perii produc, în general, scântei mici care ar putea aprinde orice vapori rătăciți.
Eterul dietilic se prepară din etanol (cunoscut și ca alcool de cereale, alcool etilic, alcool alimentar) prin încălzirea acestuia cu acid sulfuric concentrat. Reacția trece printr-un intermediar, "acidul etil sulfuric", ca majoritatea reacțiilor de acest tip. Această sinteză poate fi ușor extinsă prin mărirea proporțională a balonului de reacție și a numărului de substanțe.
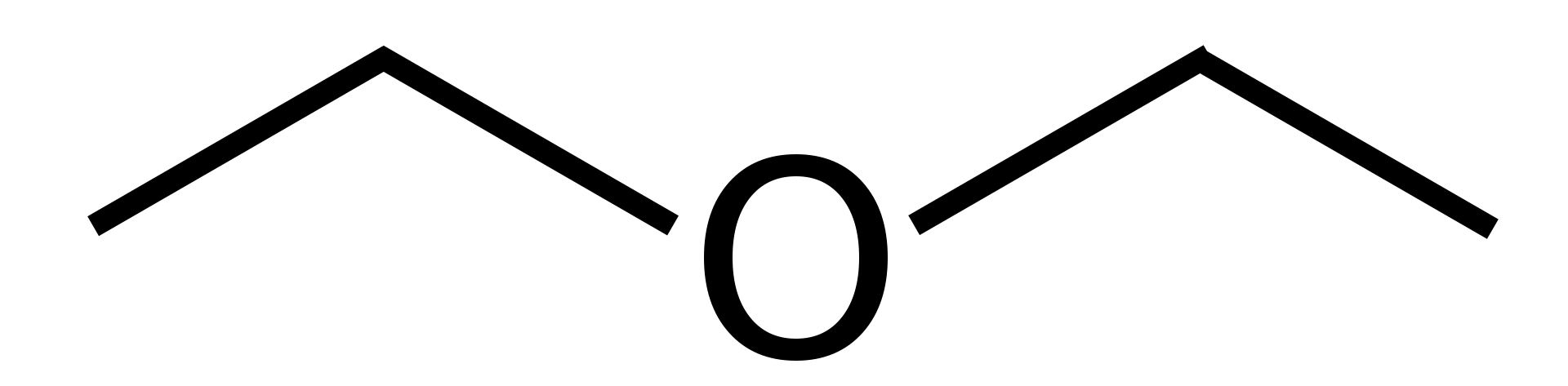
Aspect: lichid incolor cu miros uscat, de rom, dulceag;Eterul dietilic se prepară din etanol (cunoscut și ca alcool de cereale, alcool etilic, alcool alimentar) prin încălzirea acestuia cu acid sulfuric concentrat. Reacția trece printr-un intermediar, "acidul etil sulfuric", ca majoritatea reacțiilor de acest tip. Această sinteză poate fi ușor extinsă prin mărirea proporțională a balonului de reacție și a numărului de substanțe.
Punct de fierbere: 34,65 °C/760 mm Hg;
Punct de topire: -116,3 °C;
Greutate moleculară: 74,123 g/mol;
Densitate: 0,7134 g/ml (20 °C).
Echipament și sticlărie.
Instalație de distilare fracționată ;balon cu fund rotund cu trei gâturi de 0,5 L
agitator magnetic;
băi de ulei și apă cu gheață;
0.Pâlnie de picurare de 5 L x2;
Termometru de laborator (0 °C până la 200 °C) cu adaptor pentru balon;
Benzi indicatoare de pH;
Suport pentru retortă și clemă pentru fixarea aparatului;
Balanță de laborator (1 - 200 g este adecvată);
Baloane Erlenmeyer de 100 ml x2 și 200 ml x2 cu capace;
Pahare de 200 ml x2; 100 ml x2;
Cilindru de măsurare de 500 ml sau 100 ml;
Pietre de fierbere.
Reactivi.
123,9 ml (97 g, 2 mol) Etanol 95%;109 ml (200,16 g, 2 mol) Acid sulfuric (98%);
50 g Hidroxid de sodiu (NaOH);
50 g Clorură de sodiu (NaCl);
15 g Clorură de calciu (CaCl2);
~1,5 L Apă distilată;
~20 g Sodiu metalic (Na)
Manipulări
1. Deși acesta nu este cel mai plăcut proces, eterul dietilic poate fi produs prin condensarea etanolului. Pentru a face acest lucru, asamblați o instalație tipică de distilare fracționată cu o coloană vigreux și un balon cu trei gâturi. Nu uitați să introduceți un magnet agitator în balon înainte de a fixa totul și veți încălzi totul pe o baie de ulei (să știți că flăcările nu sunt permise când este vorba de eter). Coloana vigreux merge în gâtul central, o pâlnie de adiție într-un bec lateral, iar un termometru merge în celălalt gât lateral.
2. Adăugați 2x moli (unde x este un multiplicator, 1 = 2 moli, 1,5 = 3 moli etc.) de azeotropă de etanol (adică etanol 95%) în balon. Se adaugă lent 2 x moli de acid sulfuric concentrat (98 %) în etanol (se va încălzi din cauza apei) prin intermediul pâlniei de picurare. Porniți agitatorul, porniți căldura și aduceți balonul la 130 °C. Asigurați-vă căcondensatorul este bine alimentat cu apă rece și continuați încălzirea până când conținutul balonului de reacție ajunge la aproximativ 135 °C.
3. După începerea distilării, se adaugă încet până la încă 2x moli de etanol prin pâlnia de adiție, la o viteză egală cu cea a picăturilor care ies din condensator. 2 moli de alcool (123,9 g) ar trebui să dureze 1 oră cu o coloană vigreux decentă. O coloană mai scurtă (sau fără coloană deloc) va necesita o distilare mai lentă (iar dacă nu folosiți o coloană, va trebui să spălați îndelung produsul cu apă sărată).
4 . Aruncați conținutul balonului de primire într-un pahar mare sau într-un castron și amestecați cu soluție de hidroxid de sodiu (NaOH aq) 10% până când pH-ul este neutru. Se toarnă acest amestec într-o pâlnie de separare pentru a separa eterul de hidroxidul apos și se mai spală de două ori cu volume egale de soluție de clorură de sodiu (NaCl) semisaturată (~18 g/100 ml de apă la t.r.). Lăsați ultima soluție de spălare + eter să se odihnească în balon până când totul s-a sedimentat, apoi scurgeți cu grijă soluția de spălare și turnați eterul din partea superioară într-un balon cu fund rotund. Se adaugă 15 g de clorură de calciu (CaCl2) (damp rid) pentru fiecare mol de eter, se aruncă în magnetul agitatorului și se agită timp de 2 ore.
5 . Se distilează eterul din clorura de calciu prin încălzire pe o baie (ulei sau apă) la o temperatură de cel mult 45 °C. Se colectează distilatul care rezultă în intervalul 31-36 °C.
Eter etilic anhidru. Aceasta este pentru formulele care necesită eter uscat, pur sau anhidru. Produsul eteric de mai sus se usucă peste felii subțiri de sodiu metalic (și sârma de sodiu metalic funcționează bine) timp de 24 de ore. Apoi, eterul se distilează pe baie de apă, pe sodiu metalic proaspăt (proaspăt înseamnă un lot diferit de cel folosit pentru uscare).
Notă: Eterul dezvoltă peroxizi explozivi dacă stă în repaus o perioadă de timp, chiar dacă este cumpărat de la un furnizor. Prin urmare, înainte de a manipula eterul care a fost depozitat, se agită cu sulfat feros sau cu peroxid de plumb. Pentru a împiedica formarea de peroxizi în eterul proaspăt, se adaugă câteva secțiuni de sârmă de cupru sau de fier în recipientul întunecat și se păstrează într-un loc răcoros.
Purificare
4 . Aruncați conținutul balonului de primire într-un pahar mare sau într-un castron și amestecați cu soluție de hidroxid de sodiu (NaOH aq) 10% până când pH-ul este neutru. Se toarnă acest amestec într-o pâlnie de separare pentru a separa eterul de hidroxidul apos și se mai spală de două ori cu volume egale de soluție de clorură de sodiu (NaCl) semisaturată (~18 g/100 ml de apă la t.r.). Lăsați ultima soluție de spălare + eter să se odihnească în balon până când totul s-a sedimentat, apoi scurgeți cu grijă soluția de spălare și turnați eterul din partea superioară într-un balon cu fund rotund. Se adaugă 15 g de clorură de calciu (CaCl2) (damp rid) pentru fiecare mol de eter, se aruncă în magnetul agitatorului și se agită timp de 2 ore.
5 . Se distilează eterul din clorura de calciu prin încălzire pe o baie (ulei sau apă) la o temperatură de cel mult 45 °C. Se colectează distilatul care rezultă în intervalul 31-36 °C.
Eter etilic anhidru. Aceasta este pentru formulele care necesită eter uscat, pur sau anhidru. Produsul eteric de mai sus se usucă peste felii subțiri de sodiu metalic (și sârma de sodiu metalic funcționează bine) timp de 24 de ore. Apoi, eterul se distilează pe baie de apă, pe sodiu metalic proaspăt (proaspăt înseamnă un lot diferit de cel folosit pentru uscare).
Notă: Eterul dezvoltă peroxizi explozivi dacă stă în repaus o perioadă de timp, chiar dacă este cumpărat de la un furnizor. Prin urmare, înainte de a manipula eterul care a fost depozitat, se agită cu sulfat feros sau cu peroxid de plumb. Pentru a împiedica formarea de peroxizi în eterul proaspăt, se adaugă câteva secțiuni de sârmă de cupru sau de fier în recipientul întunecat și se păstrează într-un loc răcoros.
Purificare
Purificarea și uscarea eterului dietilic pentru reacțiile Grignard folosind hidroxid de potasiu și sodiu
- G.Patton
- 1
Purificarea și uscarea eterului dietilic pentru reacțiile Grignard utilizând hidroxid de potasiu și sodiu
Extracția dietil eterului și a heptanului din Starter Fluid
- G.Patton
- 5
Extracția eterului dietilic și a heptanului din lichidul de pornire
Last edited:
