G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 3,064
- Solutions
- 3
- Reaction score
- 3,501
- Points
- 113
- Deals
- 1
Reaktioner med Grignard-reagenser.
En Grignard-reagens har formeln RMgX där X är en halogen och R är en alkyl- eller arylgrupp (baserad på en bensenring). I det här sammanhanget ska vi utgå från att R är en alkylgrupp (t.ex. BuMgBr). Grignardreagenser framställs genom att halogenalkanen tillsätts till små bitar magnesium i en kolv som innehåller dietyleter. Kolven förses med enåterloppskylare och blandningen värms över ett vattenbad under 20-30 minuter.
Allt måste vara helt torrt eftersom Grignardreagenserna reagerar med vatten (se nedan). Alla reaktioner där Grignard-reagenset används utförs med den blandning som bildas vid denna reaktion. Det går inte attseparera den på något sätt.
Grignardreagens ochvatten.
Grignard-reagenser reagerar med vatten för att producera alkaner. Detta är anledningen till att allt måste vara mycket torrt under beredningen ovan. Till exempelDenoorganiska produkten Mg(OH)Br kallas "basisk bromid" och är ett slags mellanting mellan magnesiumbromid och magnesiumhydroxid.
Allmän reaktion mellan Grignards och karbonyler.
Reaktionerna mellan de olika typerna av karbonylföreningar och Grignard-reagens kan se ganska komplicerade ut, men i själva verket reagerar de alla på samma sätt - allt som förändras är de grupper som är fästa vid dubbelbindningen mellan kol och syre. Det är mycket lättare att förstå vad som händer genom att titta närmare på det allmänna fallet (med "R"-grupper snarare än specifika grupper) - och sedan lägga till de olika verkliga grupperna när det behövs.
Reaktionerna är i stort sett identiska med reaktionen med koldioxid - det enda som skiljer sig är den organiska produktens natur. I detförsta steget lägger Grignard-reagenset till över dubbelbindningen mellan kol och syre.
Reaktionerna är i stort sett identiska med reaktionen med koldioxid - det enda som skiljer sig är den organiska produktens natur. I detförsta steget lägger Grignard-reagenset till över dubbelbindningen mellan kol och syre.
Utspädd syra tillsätts sedan till detta för att hydrolysera det. (Jag använder den normalt accepterade ekvationen och ignorerar det faktum att Mg(OH)Br kommer att reagera ytterligare med syran).
En alkohol bildas. En av de viktigaste användningsområdena för Grignard-reagenser är möjligheten att enkelt framställa komplicerade alkoholer. Vilken typ av alkohol du får beror på vilken karbonylförening du började med - med andra ord, vad R och R' är.
Grignardreagenser används ofta för syntes av olika klasser av organiska föreningar. Några exempel presenteras nedan.
:
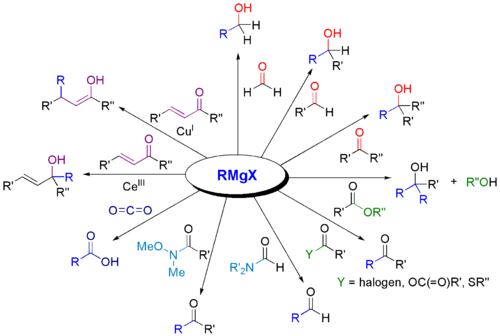
:
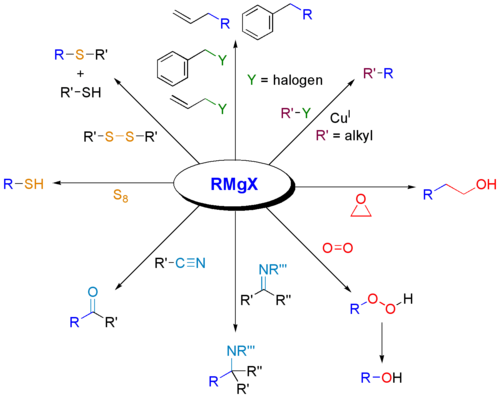
Varför reagerar Grignard-reagenser med karbonyler?
Bindningen mellan kolatomen och magnesiumet är polär. Kol är mer elektronegativt än magnesium, och därför dras det bindande elektronparet mot kolet. Det gör att kolatomen får enlätt negativ laddning.
Dubbelbindningen mellan kol och syre är också mycket polar, med en betydande mängd positiv laddning på kolatomen. Grignardreagenset kan därför fungera som nukleofil på grund av attraktionen mellan den svagt negativa laddningen hos kolatomen i Grignardreagenset och den positiva laddningen hos kolatomen i karbonylföreningen. En nukleofilär en negativ (eller svagt negativ) atom som angriper positiva (eller svagt positiva) centra i andra molekyler eller joner.
Framställning avGrignard-reagenset fenylmagnesiumbromid.
Grignard-reagenser spelar en ledande roll i organisk syntes. Dessa föreningar kan anpassas till beredningen av ett stort antal funktionella grupper, och bildandet och reaktionen av organomagnesiumderivat är en av de viktigaste användningarna av alkylhalogenider i organisk syntes. Reaktionen mellan en halogenid och magnesium sker på metallens yta och är formellt en oxidation av metallen. Reaktionen utförs vanligen i en torr eterlösning, där etern fungerar som en Lewis-bas genom att solvatisera Grignard-reagenset och låta det diffundera bort från metallen. För att bilda det metallorganiska reagenset krävs en aktiv yta på metallen och det kan vara svårt att få igång reaktionen på grund av metalloxider på metallytan. Att slipa magnesiumet i en mortel några minuter före användning är ofta effektivt för att få en ren yta. Ettannat användbart knep för att starta en reaktion är att tillsätta en liten kristall av jod till blandningen, som reagerar med magnesiumet och bildar det mycket reaktiva magnesiumjodidsaltet (MgI2).
Tillvägagångssätt.
Grignardreagenset bereds genom att först förse en torr 250 ml rundkolv med ett CaCl2-torkrör. Det magnesium som ska användas (2 g = 0,082 mol magnesiumspån) placeras i kolven, kalciumkloridröret ansluts direkt och kolven värms upp ordentligt med en stor värmemantel och reostat. Ställ in regulatorn för en stor värmemantel på läge "6" och värm kolven tills den är så varm att man kan röra vid den med fingret. Vid kylning av kolven samlas torr luft genom kalciumkloriden. Ta bort värmemanteln och låt svalna till rumstemperatur (kolven ska kännas bara lite varm i handen, eller kallare) innan du fortsätter. Ta bort torkröret för kalciumklorid och häll i 250-rundkolven 15 ml absolut eter och 9 ml (13,5 g = 0,086 mol) brombensen. Sätt tillbaka CaCl2-torkröret. Om det inte finns några omedelbara tecken på reaktion, initiera reaktionen genom att krossa några av magnesiumspånen. Detta görs genom att föra in en torr omrörarstav med en tillplattad ände och försiktigt krossa en bit magnesium ordentligt mot kolvens botten under vätskeytan och ge staven en vridande rörelse. När detta görs på rätt sätt blir vätskan något grumlig och det börjar bubbla snabbt vid ytan av den sammanpressade metallen. Tillsätt då ytterligare 25 ml absolut eter och fäst en återloppskylare på kolven och CaCl2 -röret på toppen av återloppskylaren enligt bilden.
Börja inte låta vatten rinna genom kondensorn förrän eterångorna har fuktat skarven på toppen av kondensorn. Kyl vid behov kolven genom att vidröra kolvens botten med ett isbad för att sakta ner reaktionen, men använd det inte om det inte är nödvändigt. Det är bara nödvändigt om eterångor kommer ut från toppen av torkröret. Om du måste kyla reaktionen, var försiktig så att du inte saktar ner reaktionen för mycket, eftersom den då kan stanna upp och inte starta igen när isen tas bort. Virvla kolven kraftigt var sextionde sekund. När reaktionen har börjat kan den spontana kokningen i den utspädda blandningen vara långsam eller bli långsam. Tillsätt i så fall ytterligare några ml brombensen i kolven. Reaktionen är avslutad när etern slutar bubbla och endast några små metallrester återstår. Markera eternivån i kolven. Kontrollera under reaktionen att etervolymen inte har minskat. Om den har gjort det, tillsätt mer torr eter. Eftersom lösningen av Grignard-reagenset försämras när den står stilla, bör nästa steg påbörjas omedelbart.
Kondensation av Grignard-reagenset med metylbensoat.
Kondensation av Grignard-reagenset med metylbensoat.
Blanda 5 g (0,037 mol; 1,09 g/ml) metylbensoat och 15 ml absoluteter i en separertratt, kyl kolven som innehåller Grignard-reagenslösningen kort i ett isbad. Ta bort torkröret och sätt in en Claisen-adapter och en separeringstratt i toppen av kondensorn enligt bilden till höger. Häll i metylbensoatlösningen droppvis under tio minuter, med endast den kylning som krävs för att kontrollera den exoterma reaktionen. Produktsaltet avskiljer sig som ett vitt fast ämne under detta steg. Sväng kolven med jämna mellanrum tills reaktionen har avtagit och kolven har rumstemperatur. Gå direkt till nästa steg.
Hydrolys av tillsatsprodukten.
Hydrolys av tillsatsprodukten.
Häll försiktigt över reaktionsblandningen i en 250 ml Erlenmeyerkolv innehållande 50 ml 10% svavelsyra och ca 25 g is. Använd några ml vanlig (icke vattenfri) eter och några ml av den 10 %iga svavelsyran för att skölja reaktionskolven. Tillsätt dessa sköljningar till Erlenmeyerkolven. Virvla väl för att främja hydrolysen av tillsatsföreningen; basiska magnesiumsalter omvandlas till vattenlösliga neutrala salter och trifenylkarbinol fördelas i eterskiktet. En ytterligare mängd eter (vanlig) kan behövas om det ursprungliga eterskiktet har blivit för lågt genom avdunstning. Du kan sluta här om det inte finns tillräckligt med tid för att slutföra nästa del. Förvara den märkta Erlenmeyer-kolven i huven med en lätt monterad korkpropp (inte gummi). Proppen ska vara tillräckligt lös för att eventuellt gastryck från utvecklad vätgas ska släppas ut.
När den oförbrukade Mg-metallen kommer i kontakt med syran, kommer det att ske en kraftig utveckling av vätgas och reaktionsblandningen kan skumma över om tillsatsen sker för snabbt.
Isolering av produkten.
Om eterskiktet har fasta vita kristaller, har dessa produktkristaller bildats eftersom något eterskikt har avdunstat. Dessa kristaller kan isoleras genom att hälla blandningen i en separeringstratt genom en glastratt med en liten plugg av glasull i skaftet. Skölj kristallerna med en liten mängd eterlösningsmedel. För att isolera den återstående produkten, skölj Erlenmeyerkolven, från vilken du hällde den ursprungliga lösningen, med några ml vanlig eter och tillsätt denna till separeringstratten. Skaka tratten och var noga med att ventilera bort den gas som bildas i tratten. Dra av det vattenhaltiga skiktet. Skaka eterskiktet med 10% svavelsyra för att ytterligare avlägsna magnesiumsalter och avlägsna svavelsyraskiktet. Tvätta eterskiktet med mättad natriumkloridlösning för att avlägsna vatten som har lösts i etern. Avlägsna natriumkloridlösningen. Mängden vätska som används vid dessa tvättoperationer är inte kritisk. I allmänhet är en mängd tvättvätska som motsvarar en tredjedel av etervolymen tillräcklig. För att åstadkomma slutlig torkning av eterlösningen häller du eterskiktet från separertrattens hals i en Erlenmeyerkolv, tillsätter ca 5 g vattenfritt natriumsulfat i granulatform, virvlar kolven då och då och dekanterar etern från det fasta torkmedlet efter 5 minuter till en annan ren, torr Erlenmeyerkolv. Tillsätt 25 ml ligroin till eterlösningen och förslut kolven med en korkpropp. Låt blandningen stå över natten eller fram till nästa labbperiod. Efter att ha stått bör kristaller av trifenylkarbinol ha bildats. Den största föroreningen bifenyl ska fortfarande vara löslig i omkristallisationslösningsmedlet. Filtrera kristallerna genom sugfiltrering tills de är torra. Anteckna vikten av den isolerade produkten och beräkna utbytet i %. Ta ensmältpunkt.
När den oförbrukade Mg-metallen kommer i kontakt med syran, kommer det att ske en kraftig utveckling av vätgas och reaktionsblandningen kan skumma över om tillsatsen sker för snabbt.
Isolering av produkten.
Om eterskiktet har fasta vita kristaller, har dessa produktkristaller bildats eftersom något eterskikt har avdunstat. Dessa kristaller kan isoleras genom att hälla blandningen i en separeringstratt genom en glastratt med en liten plugg av glasull i skaftet. Skölj kristallerna med en liten mängd eterlösningsmedel. För att isolera den återstående produkten, skölj Erlenmeyerkolven, från vilken du hällde den ursprungliga lösningen, med några ml vanlig eter och tillsätt denna till separeringstratten. Skaka tratten och var noga med att ventilera bort den gas som bildas i tratten. Dra av det vattenhaltiga skiktet. Skaka eterskiktet med 10% svavelsyra för att ytterligare avlägsna magnesiumsalter och avlägsna svavelsyraskiktet. Tvätta eterskiktet med mättad natriumkloridlösning för att avlägsna vatten som har lösts i etern. Avlägsna natriumkloridlösningen. Mängden vätska som används vid dessa tvättoperationer är inte kritisk. I allmänhet är en mängd tvättvätska som motsvarar en tredjedel av etervolymen tillräcklig. För att åstadkomma slutlig torkning av eterlösningen häller du eterskiktet från separertrattens hals i en Erlenmeyerkolv, tillsätter ca 5 g vattenfritt natriumsulfat i granulatform, virvlar kolven då och då och dekanterar etern från det fasta torkmedlet efter 5 minuter till en annan ren, torr Erlenmeyerkolv. Tillsätt 25 ml ligroin till eterlösningen och förslut kolven med en korkpropp. Låt blandningen stå över natten eller fram till nästa labbperiod. Efter att ha stått bör kristaller av trifenylkarbinol ha bildats. Den största föroreningen bifenyl ska fortfarande vara löslig i omkristallisationslösningsmedlet. Filtrera kristallerna genom sugfiltrering tills de är torra. Anteckna vikten av den isolerade produkten och beräkna utbytet i %. Ta ensmältpunkt.
Synteser av psykoaktiva ämnen med Grignard-reagens.
Grignardreagenset används vid syntesen av flera ytaktiva ämnen. Till exempel vid syntes av syntetiska cannabinoider för att binda en alkylgrupp till indolens kväveatom (se exempel på syntes av JWH-018 ). Reaktionen går ganska snabbt under milda förhållanden och kräver ingen uppvärmning.
Den nukleofila additionen av Grignard-reagenset möjliggör en viss icke-specifik och stereospecifik reaktion för att producera amfetamin ochdess prekursor såsom fenyl-2-propanon (P2P).
Enannan metod för tillämpning av Grignard-reagens är användning i vägen tillmefedron (4-MMC) syntes med användning av 4-metylbensaldehyd som utgångsmaterial.
Reaktionen av indolylmagnesiumjodid med substituerade alkylhalogenider, t.ex. nitrilerna Cl(CH2)nCN och kloracetyldietylamid, för att ge motsvarande 3-substituerade indoler är välkänd, även om mycket reaktiva halogenider, t.ex. metyljodid och bensylklorid, ibland ger 1,3-disubstituerade indoler. Denna DMT-väg ärmöjlig med hjälp av Grignard-reagens.
Förutom tidigare olika applikationer används detta populära tillvägagångssätt i ketaminsyntessteget för(o-klorfenyl) -cyklopentylketontillverkning.
Slutsats.
Som du kan se används Grignard-reagens i stor utsträckning i organiska synteser och läkemedelstillverkning delvis. Alkylmagnesiumhalogenider (även kallade Grignard-reagenser) fungerar som nukleofiler och attackerar en elektrofil kolatom för att bilda en kol-kolbindning. Grignard-reaktionen är en viktig metod för att skapa kol-kolbindningar samt kol-heteroatombindningar. Denna lista över de mest populära reaktionerna bland hemliga kemister visar den enorma potentialen för Grignardreagenstillämpningar och utgör ett stort forskningsområde.
Last edited:
