G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,659
- Solutions
- 3
- Reaction score
- 2,734
- Points
- 113
- Deals
- 1
Indledning.
Denne fil handler om syntese af GHB og beslægtede forbindelser. Det er meget farligt at forsøge sig med en syntese af GHB uden den rette viden om praktisk organisk kemi. Den mest enkle måde at fremstille GHB på er ved hydrolyse af den tilsvarende lacton (en cyklisk intramolekylær ester) til den ønskede hydroxysyre. Esterhydrolyse kan udføres på to måder: En syrekatalyseret reaktion eller en basekatalyseret reaktion. Den basekatalyserede reaktion er vores valg her, fordi reaktionen ikke er reversibel som den syrekatalyserede, og derfor får vi et højere udbytte, og vi får natriumsaltet af GHB, da den frie syre ikke er stabil og straks vil cykle ind i gamma-butyrolacton igen.
Omdannelse afgamma-butyrolacton til natrium-gamma-hydroxybutyrat (Na-GHB).
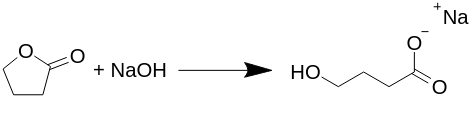
Reaktionen forløber ækvimolært (det samme antal af hvert molekyle reagerer), og der produceres ingen biprodukter i denne reaktion, såsom brintgas, vand eller andet, som foreslået i flere andre tekster. Alle publicerede præparater af GHB, eller mere korrekt Na-GHB, tilbagesvaler butyrolacton med natriumhydroxid i forskellige opløsningsmidler, normalt i vandig alkohol, men det er ikke nødvendigt.
Fysiske/kemiske egenskaber.
gamma-butyrolacton.
Molvægt 86,09; mp -43,53 °C; bp 204 °C; d 1,12 g/ml
CAS-nr: [96-48-0]
Blandbar med vand, opløselig i methanol, ethanol, acetone, ether, benzen
LD50: 1720 mg/kg (oralt, mus) 1540 mg/kg (oralt, rotte)
Anvendelser: Opløsningsmiddel, malingsfjerner, kondensatorelektrolyt, i organisk kemi
Synonymer: GBL, BLO, butyrolacton, gamma-hydroxysmørsyrelacton, 1,2-butanolid, 1,4-butanolid, 4-butanolid, 2-oxanolon, tetrahydro-2-furanon, dihydro-2(3H)-furanon.
Sodium GHB.
Mol wt 126,09; mp 145-146 °C
CAS No: [502-85-2]
LD50:2700 mg/kg (oralt, rotte)
Synonymer: Gamma-OH, natriumoxybat, natriumgamma-oxybutyrat, Somatomax PM, Wy-3478, NSC-84223, Somsanit, Anetamin.
Kalium GHB.
Molvægt: 142,20
Calcium GHB.
Molvægt246,16; smp 164-166 °C, 166-168 °C.
Magnesium GHB.
Molvægt 230,39; smp (vandfri) 172-174 °C; tetrahydrat 118-120 °C; pentahydrat 76-78 °C.
Molvægt 86,09; mp -43,53 °C; bp 204 °C; d 1,12 g/ml
CAS-nr: [96-48-0]
Blandbar med vand, opløselig i methanol, ethanol, acetone, ether, benzen
LD50: 1720 mg/kg (oralt, mus) 1540 mg/kg (oralt, rotte)
Anvendelser: Opløsningsmiddel, malingsfjerner, kondensatorelektrolyt, i organisk kemi
Synonymer: GBL, BLO, butyrolacton, gamma-hydroxysmørsyrelacton, 1,2-butanolid, 1,4-butanolid, 4-butanolid, 2-oxanolon, tetrahydro-2-furanon, dihydro-2(3H)-furanon.
Sodium GHB.
Mol wt 126,09; mp 145-146 °C
CAS No: [502-85-2]
LD50:2700 mg/kg (oralt, rotte)
Synonymer: Gamma-OH, natriumoxybat, natriumgamma-oxybutyrat, Somatomax PM, Wy-3478, NSC-84223, Somsanit, Anetamin.
Kalium GHB.
Molvægt: 142,20
Calcium GHB.
Molvægt246,16; smp 164-166 °C, 166-168 °C.
Magnesium GHB.
Molvægt 230,39; smp (vandfri) 172-174 °C; tetrahydrat 118-120 °C; pentahydrat 76-78 °C.
Laboratorieprocedurer for syntese af GHB-salte.
Følg de almindelige sikkerhedsprocedurer i laboratoriet. Bær kittel og beskyttelsesbriller. Du kommer til at arbejde med varme kaustiske opløsninger og opløsningsmidler! Vær opmærksom på de risici, der er forbundet med fremstilling af GHB! Arbejd aldrig alene!
Sodium GHB.
Procedure:
Opløs 130 gram (3,25 mol) ren natriumhydroxid i 400 ml destilleret vand i en 1000 ml trehalset rundbundet kolbe under omrøring. Opløsningen er eksoterm, og opløsningen vil blive varm. Et koldt vandbad kan bruges til at regulere temperaturen. Når alt er opløst til en klar opløsning, tilsættes langsomt 250 ml (280 g, 3,25 mol) gamma-butyrolacton i portioner på 50 ml under god omrøring. Det anbefales at bruge en dråbetragt. Tilsætningen af gamma-butyrolacton til natriumhydroxidopløsningen er også eksoterm, og hvis den tilsættes for hurtigt, vil opløsningen begynde at koge, og det ønsker vi ikke. Hold øje med temperaturen med et nedsænket termometer. Tilsætningen af gamma-butyrolacton vil tage et sted mellem 20-30 minutter. Når alt er tilsat, lader du blandingen reagere i yderligere 10 minutter under lejlighedsvis omrøring.
Nu er det tid til at se, om reaktionen er afsluttet ved at kontrollere pH-værdien med universelt pH-papir. Vi sigter efter en pH-værdi på 7-8. Hvis den er for høj (pH > 8), skal du tilsætte 10 ml gamma-butyrolacton og lade det reagere i et par minutter mere. Hvis pH-værdien er for lav (pH < 7), tilsættes et par ml koncentreret NaOH aq. opløsning. Fortsæt på denne måde, indtil pH-niveauet er inden for de ønskede grænser.
Opløsningen er helt klar og smager let salt. Den kan være lidt gul, men ikke meget, hvis der er brugt ren nok butyrolacton (destillation af lactonen før brug løser dette problem, b.p. 204 °C). Hvis man bruger en syre til at neutralisere en for basisk opløsning (i stedet for at tilsætte mere lakton), kan krystaller af syrens natriumsalt udfældes i opløsningen, og smagen forringes kraftigt. Den endelige opløsning vil være omkring 750 ml, 50% NaGHB. Opløsningen kan koncentreres (ved at koge overskydende vand væk) til ca. 600 ml, uden at den krystalliserer ved stuetemperatur, men hvis den koncentreres helt ned til ca. 500 ml, vil den uvægerligt størkne.
Nu er det tid til at se, om reaktionen er afsluttet ved at kontrollere pH-værdien med universelt pH-papir. Vi sigter efter en pH-værdi på 7-8. Hvis den er for høj (pH > 8), skal du tilsætte 10 ml gamma-butyrolacton og lade det reagere i et par minutter mere. Hvis pH-værdien er for lav (pH < 7), tilsættes et par ml koncentreret NaOH aq. opløsning. Fortsæt på denne måde, indtil pH-niveauet er inden for de ønskede grænser.
Opløsningen er helt klar og smager let salt. Den kan være lidt gul, men ikke meget, hvis der er brugt ren nok butyrolacton (destillation af lactonen før brug løser dette problem, b.p. 204 °C). Hvis man bruger en syre til at neutralisere en for basisk opløsning (i stedet for at tilsætte mere lakton), kan krystaller af syrens natriumsalt udfældes i opløsningen, og smagen forringes kraftigt. Den endelige opløsning vil være omkring 750 ml, 50% NaGHB. Opløsningen kan koncentreres (ved at koge overskydende vand væk) til ca. 600 ml, uden at den krystalliserer ved stuetemperatur, men hvis den koncentreres helt ned til ca. 500 ml, vil den uvægerligt størkne.
Fremstilling afnatrium-GHB ved hjælp af natriumbikarbonat (bagepulver, NaHCO3).
Tilsæt 273 g NaHCO3 (3,25 mol) til 1125 ml destilleret vand i en trehalset rundbundet kolbe. Bring langsomt opløsningen i kog under omrøring med en glasstav eller lignende. Al bagepulveret vil blive opløst. Man vil kunne se kuldioxid forlade opløsningen, når den koger. Det ernatriumbicarbonat, der nedbrydes til en lidt stærk base, natriumcarbonat.
Reducer varmen til et let opkog, og tilsæt langsomt 250 ml gamma-butyrolacton (280 g, 3,25 mol). Tilsætningen er ikke umiddelbart eksoterm, som med natriumhydroxidsyntesen. Hold denne opløsning ved let kog i 30 minutter. Kontroller pH-værdien med universelt pH-papir. Vi sigter efter en pH-værdi omkring 7, men alt mellem 6 og 8 er helt sikkert. Hvis pH-værdien er for høj, tilsættes en lille smule mere GBL, og der fortsættes med tilbagesvaling.
Opløsningen bliver helt klar og skal være helt farveløs. Hvis den ikke er helt farveløs, dvs. hvis der er brugt lidt uren butyrolacton, og opløsningen har fået en lysegul farve, skal du tilsætte ca. 100 ml aktivt kul. Lad dette koge i 10 minutter. Afkøl opløsningen, filtrer derefter, og vask det aktive kul to eller tre gange med 50 ml koldt vand. Der fremstilles 410 g NaGHB i denne syntese. Denne opløsning kan koncentreres til ca. 50 % NaGHB, før den begynder at krystallisere. Hvis du ønsker et pulver, skal du opvarme, indtil opløsningen når en temperatur på 150 °C, og derefter hælde den på en afkølet Pyrex-skål og lade den afkøle og størkne. Denne syntese er perfekt til brug, hvor der ikke findes natriumhydroxid af ACS-, fødevare- eller elektronikkvalitet.
Opløsningen bliver helt klar og skal være helt farveløs. Hvis den ikke er helt farveløs, dvs. hvis der er brugt lidt uren butyrolacton, og opløsningen har fået en lysegul farve, skal du tilsætte ca. 100 ml aktivt kul. Lad dette koge i 10 minutter. Afkøl opløsningen, filtrer derefter, og vask det aktive kul to eller tre gange med 50 ml koldt vand. Der fremstilles 410 g NaGHB i denne syntese. Denne opløsning kan koncentreres til ca. 50 % NaGHB, før den begynder at krystallisere. Hvis du ønsker et pulver, skal du opvarme, indtil opløsningen når en temperatur på 150 °C, og derefter hælde den på en afkølet Pyrex-skål og lade den afkøle og størkne. Denne syntese er perfekt til brug, hvor der ikke findes natriumhydroxid af ACS-, fødevare- eller elektronikkvalitet.
Kalium GHB.
Brug ethanolsyntesen beskrevet ovenfor for natrium-GHB, men erstat de 130 gram NaOH med 182 gram KOH (denne beregning er baseret på det tungere K-atom og det højere vandindhold i KOH i forhold til NaOH). Ved at bruge KOH får brugere af K-GHB det kaliumtilskud, som nogle mener, der er behov for i forbindelse med indtagelse af GHB. Husk, at (pulveriseret) K-GHB er lidt mindre aktivt (efter vægt) end Na-GHB, da K-ionen er tungere end Na-modstykket. Forskellen mellem K-GHB og Na-GHB er, at K-saltet er mere opløseligt i vand end Na-saltet, og at smagen minder mere om salt/lakrids end Na-GHB's salt/sæbesmag.
Calcium GHB.
74 g analytisk rent calciumhydroxid opslæmmes i 200 ml destilleret vand. 160 ml 4-butyrolacton tilsættes i portioner (hver portion ca. 5 til 10 ml) og under omrøring til denne suspension ved stuetemperatur. Efter tilsætning af 20 ml opvarmes reaktionsblandingen til ca. 50 °C til 60 °C. Tilsætningen af 4-butyrolacton kontrolleres således, at temperaturen forbliver mellem ca. 50 °C og 60 °C, hvilket tager ca. 1 time. I løbet af denne tid er calciumhydroxidet opløst praktisk talt fuldstændigt. Reaktionsmaterialet er forurenet med et let rustgult bundfald. Det fortyndes med 300 ml methanol, får lov til at stå i fire timer og filtreres derefter gennem et foldefilter. Det klare filtrat behandles forsigtigt med 200 ml acetone på den måde, at der efter hver portion acetone, der forårsager et bundfald, gives tid til, at bundfaldet opløses igen. Der opnås en vandklar opløsning, som placeres til krystallisering. Efter to timers henstand begynder farveløse krystaller at aflejre sig. I denne tilstand fremskyndes krystalliseringen ved kontinuerlig tilsætning af acetone (i alt 100 ml). Krystalliseringstiden er 24 timer. Krystallerne suges af og vaskes først med 50 ml methanol og derefter yderligere med 60 ml acetone. Krystallerne tørres ved temperaturer fra ca. 60 °C til 80 °C i et tørreskab. Udbytte: 230 g. Smeltepunkt 166-168 °C. (med det samme). Produktet er det vandfrie, ikke-hygroskopiske calciumsalt af 4-hydroxysmørsyre. Det kan opløses som ønsket i vand, og den vandige opløsning har en pH-værdi på 7 til 7,5. Saltet kan opbevares så længe som ønsket og ændrer sig ikke i luften. Selv ved opbevaring tiltrækkes der ikke vand fra luften.
Resten krystalliserer til en masse farveløse krystaller, som efter tørring ved temperaturer fra ca. 60 °C til 80 °C. Udbytte: ca. 105 g. Smeltepunkt 164-166 °C. Produktet er Di-(4-hydroxysmørsyre)-calcium. Det omkrystalliseres ved at opløse det i lidt methanol, efterfulgt af tilsætning af acetone til uklarhed og krystallisering i kulden.
I stedet for methanol kan også ethanol og isopropanol anvendes til omkrystallisering med samme succes. Uden brug af vandholdige alkoholer som omkrystallisationsmedium eller som tilsætningsstof til omkrystallisation og rensning opnås der ingen stabile og især ingen ikke-hygroskopiske calciumsalte. Vandindholdet i alkoholerne bør være fra ca. 3-10 volumenprocent. Det således opnåede slutprodukt opløses let i vand, er ikke hydroskopisk og har en behagelig aromatisk lugt.
Resten krystalliserer til en masse farveløse krystaller, som efter tørring ved temperaturer fra ca. 60 °C til 80 °C. Udbytte: ca. 105 g. Smeltepunkt 164-166 °C. Produktet er Di-(4-hydroxysmørsyre)-calcium. Det omkrystalliseres ved at opløse det i lidt methanol, efterfulgt af tilsætning af acetone til uklarhed og krystallisering i kulden.
I stedet for methanol kan også ethanol og isopropanol anvendes til omkrystallisering med samme succes. Uden brug af vandholdige alkoholer som omkrystallisationsmedium eller som tilsætningsstof til omkrystallisation og rensning opnås der ingen stabile og især ingen ikke-hygroskopiske calciumsalte. Vandindholdet i alkoholerne bør være fra ca. 3-10 volumenprocent. Det således opnåede slutprodukt opløses let i vand, er ikke hydroskopisk og har en behagelig aromatisk lugt.
MagnesiumGHB .
60 g magnesiumhydroxid (analytisk kvalitet) opslæmmes i 200 ml postevand under omrøring. I en strøm og under omrøring blandes 160 ml butyrolacton i denne suspension. Derefter opvarmes blandingen på et vandbad i 6 timer under omrøring i en 2-liters-flaske. Magnesiumhydroxiden opløses næsten fuldstændigt. Kolben får lov til at stå natten over, mens forureninger aflejres, og opløsningen dekanteres uden anstrengelse fra forureningsaflejringen. Det vandklare dekanat omrøres først med 100 ml acetone i 10 minutter. Den farveløse sirupsagtige væske, som nu er blevet mere tyktflydende, blandes igen med 100 ml acetone som beskrevet ovenfor, acetonen fjernes igen ved dekantering, og den ret tyktflydende, farveløse sirup overlades til sig selv ved stuetemperatur i ca. 2 til 4 timer. Den størkner til en farveløs krystalmasse, som findeles i en morter og tørres i flere timer i luft. Smeltepunkt 76 °C til 78 °C. Udbytte: 314 g i analytisk ren form.
Dette magnesiumsalt indeholder ca. 5 mol hydratiseringsvand. Det er ikke hydroskopisk, er stabilt og kan opbevares i vilkårlig lang tid. Ved tørring over flere timer ved 40 °C til 50 °C mister det en del af sit krystallisationsvand (1 mol) og smelter derefter ved 118 °C til 120 °C. Vandfrit magnesium-4-hydroxybutyrat kan fremstilles ved at fjerne vand vedsublimering og/eller fordampning af vand under nedsat partialtryk af vand og ved forhøjet temperatur eller ved krystallisering fra en opløsning, der indeholder et organisk opløsningsmiddel. Det vandfri salt smelter ved 172-174 °C. Den kemiske analyse viser 10,50 vægtprocent magnesium (beregnet 10,55 vægtprocent magnesium). Alle modifikationer er ikke-hygroskopiske og stabile under opbevaring. 1 g af magnesiumsaltet opløses i 2 ml vand ved stuetemperatur, den vandige opløsnings pH er 7. Det opløses let i vand, methanol og ethanol, det opløses ikke i ether og kulbrinter, det er ikke hygroskopisk, kan opbevares og har en behagelig aromatisk lugt.
Dette magnesiumsalt indeholder ca. 5 mol hydratiseringsvand. Det er ikke hydroskopisk, er stabilt og kan opbevares i vilkårlig lang tid. Ved tørring over flere timer ved 40 °C til 50 °C mister det en del af sit krystallisationsvand (1 mol) og smelter derefter ved 118 °C til 120 °C. Vandfrit magnesium-4-hydroxybutyrat kan fremstilles ved at fjerne vand vedsublimering og/eller fordampning af vand under nedsat partialtryk af vand og ved forhøjet temperatur eller ved krystallisering fra en opløsning, der indeholder et organisk opløsningsmiddel. Det vandfri salt smelter ved 172-174 °C. Den kemiske analyse viser 10,50 vægtprocent magnesium (beregnet 10,55 vægtprocent magnesium). Alle modifikationer er ikke-hygroskopiske og stabile under opbevaring. 1 g af magnesiumsaltet opløses i 2 ml vand ved stuetemperatur, den vandige opløsnings pH er 7. Det opløses let i vand, methanol og ethanol, det opløses ikke i ether og kulbrinter, det er ikke hygroskopisk, kan opbevares og har en behagelig aromatisk lugt.
Andre salte.
Litium- og ammoniumsalte af GHB ville være farlige at indtage. Litium-ion er giftigt, og sammen med NH3-lakton bliver det til pyrrolidon.
Spørgsmål og svar om syntese.
Q: Kan jeg bruge lud i stedet for ren natriumhydroxid?
A: Nej, det kan have uforudsigelige konsekvenser for dit helbred. Lud fra byggemarkeder har ikke nær så strenge renhedskriterier som f.eks. fødevarekvalitet, ACS-kvalitet eller elektronikkvalitet. Nogle mennesker fortæller om vellykkede historier med lud, hvilket virkelig er muligt, men som sagt er resultaterne uforudsigelige.
Q: Jeg har ikke de glasvarer, du siger, der er brug for, kan jeg koge opløsningen i en gryde på komfuret i stedet?
A: Nej, det kan du ikke. Natriumhydroxiden vil korrodere metallet, og diverse metalioner vil komme ind i dit produkt. Du kan selvfølgelig bruge enklere glasvarer end i mine forslag og foretage de nødvendige justeringer af proceduren.
Q: Jeg kan ikke omkrystallisere Na-GHB fra ethanol. Det bliver en klistret masse.
A: Din Na-GHB er ikke tør, eller din ethanol er ikke vandfri. Vand gør omkrystalliseringen næsten umulig. Det bliver ikke bedre af, at natrium-GHB er flydende (hygroskopisk). Du skal tørre GHB'en grundigt, helst i en vakuumekssikkator, før du forsøger dig med omkrystallisering eller andre improviserede alternativer. Den ethanol, du planlægger at bruge (oftest leveret i en renhed på 95 %, resten er vand), skal tørres ved tørring over vandfrit calciumsulfat efterfulgt af destillation fra calciumoxid med passende foranstaltninger til at udelukke fugt fra reaktionen.
Q: Hvor kan jeg købe butyrolacton / Er det sikkert at købe butyrolacton?
A: Jeg har ingen idé om, hvordan situationen er for dig i dit land. Svarene på disse spørgsmål afhænger i høj grad af, hvem du er, og hvor du bor. Du kan dog kontakte en af de mange sælgere af GHB-sæt, som du kan finde online.
A: Nej, det kan have uforudsigelige konsekvenser for dit helbred. Lud fra byggemarkeder har ikke nær så strenge renhedskriterier som f.eks. fødevarekvalitet, ACS-kvalitet eller elektronikkvalitet. Nogle mennesker fortæller om vellykkede historier med lud, hvilket virkelig er muligt, men som sagt er resultaterne uforudsigelige.
Q: Jeg har ikke de glasvarer, du siger, der er brug for, kan jeg koge opløsningen i en gryde på komfuret i stedet?
A: Nej, det kan du ikke. Natriumhydroxiden vil korrodere metallet, og diverse metalioner vil komme ind i dit produkt. Du kan selvfølgelig bruge enklere glasvarer end i mine forslag og foretage de nødvendige justeringer af proceduren.
Q: Jeg kan ikke omkrystallisere Na-GHB fra ethanol. Det bliver en klistret masse.
A: Din Na-GHB er ikke tør, eller din ethanol er ikke vandfri. Vand gør omkrystalliseringen næsten umulig. Det bliver ikke bedre af, at natrium-GHB er flydende (hygroskopisk). Du skal tørre GHB'en grundigt, helst i en vakuumekssikkator, før du forsøger dig med omkrystallisering eller andre improviserede alternativer. Den ethanol, du planlægger at bruge (oftest leveret i en renhed på 95 %, resten er vand), skal tørres ved tørring over vandfrit calciumsulfat efterfulgt af destillation fra calciumoxid med passende foranstaltninger til at udelukke fugt fra reaktionen.
Q: Hvor kan jeg købe butyrolacton / Er det sikkert at købe butyrolacton?
A: Jeg har ingen idé om, hvordan situationen er for dig i dit land. Svarene på disse spørgsmål afhænger i høj grad af, hvem du er, og hvor du bor. Du kan dog kontakte en af de mange sælgere af GHB-sæt, som du kan finde online.
Forstadier.
Den åbenlyse forløber for syntesen af GHB er gamma-butyrolacton. Det kan fremstilles af forstadier som tetrahydrofuran (THF) med oxidationsmidler som rutheniumtetroxid, calciumhypochlorit og salpetersyre. 4-Halosmørsyre-derivater (klor, brom, jod) kan også bruges. Som i nedenstående syntese kan de omdannes til gamma-butyrolacton ved destillation med natriummethoxid.
gamma-butyrolacton fra 4-bromsmørsyre.
Til en opløsning af 7,8 g natrium i 500 ml absolut alkohol blev der tilsat 60,5 g 4-bromsmørsyre. Reaktionsblandingen blev kogt under en tilbagesvalingskondensator i ca. fem timer. I løbet af denne tid blev natriumbromid adskilt. Alkoholen blev destilleret fra et dampbad, og lactonen blev adskilt fra natriumbromidet ved ekstraktion med ether. Eteren blev inddampet, og laktonen blev destilleret under almindeligt tryk. Udbyttet var 21,2 gram (67 %) af et produkt, der kogte ved 202-206 °C. Et alternativ kan være fri radikal klorering af smørsyre med svovlklorid i nærvær af peroxider og adskillelse af isomerer gennem destillation, fremstilling af natriumsaltet af 4-chlorsmørsyre og cyklisering til laktonen som med 4-bromerivatet ovenfor. gamma-butyrolacton kan også fremstilles af 4-methoxysmørsyre, 3-phenoxypropylcyanid, gamma-diethylaminosmørsyre og beta-chlorethylvinylether samt mange andre lidt for eksotiske kemikalier. Industrielt fremstilles det almindeligvis ved at lade acetylen reagere med formaldehyd under høje temperaturer og tryk.
Dehydrogenering af 1,4-butandiol (BDO) til gamma-butyrolacton (GBL).
En blanding af 90,1 g (1 mol) 1,4-butandiol, 4 g kobberkromitkatalysator og 0,15 g pulveriseret natriumhydroxid af reagenskvalitet (eller bedre KOH) blev omrørt kraftigt og opvarmet under tilbagesvaling. Ved ca. 200 °C skete der en livlig udvikling af brint, og temperaturen faldt ca. 10 °C, og dehydrogeneringen gik glat. Gasudviklingen (39 L/2 mol pr. omsat mol 1,4-butandiol) ophørte i løbet af ca. 3 timer. Reaktionsblandingen blev afkølet til stuetemperatur, filtreret fra katalysatoren og destilleret under reduceret tryk for at give gamma-butyrolacton i ca. 80 % udbytte og ureageret 1,4-butandiol i ca. 10 % udbytte.
Fremstilling af højaktiv kobberchromit dehydrogeneringskatalysator.
En opløsning af 260 g kobber(II)nitrat-trihydrat i 900 ml postevand ved 80 °C blev under omrøring tilsat en opløsning af 178 g natriumdichromat-dihydrat og 225 ml 28 % NH4OH, der blev fyldt op til 900 ml ved 25 °C. Bundfaldet blev opsamlet ved sugefiltrering og opslæmmet i vand tre gange. Kobberammoniumkromatet blev tørret ved 75-80 °C natten over. Det blev pulveriseret og tilsat i små portioner til en 1-liters 3-hals-kolbe udstyret med en Hershberg-omrører i rustfrit stål, som skrabede tæt på bunden af kolben. Kolben blev delvist nedsænket i et oliebad ved 350 °C (med 300-320 °C kan man opnå gode resultater). Tilsætningen varede 15 minutter (der udvikledes en masse dampe), og blandingen blev omrørt ved 350 °C i yderligere 15 minutter, efter at alt var færdigt. Detafkølede og sorte støvede pulver blev brugt som det er til dehydrogeneringen.
En opløsning af 260 g kobber(II)nitrat-trihydrat i 900 ml postevand ved 80 °C blev under omrøring tilsat en opløsning af 178 g natriumdichromat-dihydrat og 225 ml 28 % NH4OH, der blev fyldt op til 900 ml ved 25 °C. Bundfaldet blev opsamlet ved sugefiltrering og opslæmmet i vand tre gange. Kobberammoniumkromatet blev tørret ved 75-80 °C natten over. Det blev pulveriseret og tilsat i små portioner til en 1-liters 3-hals-kolbe udstyret med en Hershberg-omrører i rustfrit stål, som skrabede tæt på bunden af kolben. Kolben blev delvist nedsænket i et oliebad ved 350 °C (med 300-320 °C kan man opnå gode resultater). Tilsætningen varede 15 minutter (der udvikledes en masse dampe), og blandingen blev omrørt ved 350 °C i yderligere 15 minutter, efter at alt var færdigt. Detafkølede og sorte støvede pulver blev brugt som det er til dehydrogeneringen.
Syntese af gamma-butyrolacton fra tetrahydrofuran (THF).
Til en omrørt blanding af 7,2 g (0,1 mol) tetrahydrofuran i 100 ml vand blev der tilsat 15,1 g natriumbromat og 13,6 g (0,1 mol) kaliumhydrogensulfat. Ekstern afkøling var nødvendig for at holde opløsningens temperatur mellem 25-30 °C. Omrøringen fortsatte i 16 timer ved stuetemperatur, hvorefter al THF var opbrugt. For at slukke eventuelt overskydende brom blev der brugt en sur natriumsulfitopløsning [bisulfit burde fungere lige så godt]. Der blev således tilsat 140-150 ml af en 10 % opløsning og 13,6 g (0,1 mol) kaliumhydrogensulfat. Reaktionen blev afkølet og ekstraheret med 5x30 ml dichlormethan. De kombinerede organiske lag blev tørret over MgSO4, og opløsningsmidlet blev fjernet under vakuum. Resten blev destilleret for at give gamma-butyrolacton i 73 % udbytte (bp 204-205 °C).
Sandmeyer-reaktion af GABA til GBL/GHB.
Det er fantastisk for en kemiker, der ønsker at fremstille GHB i små mængder og med højt udbytte og at gøre det uden direkte at få regulerede kemikalier som gamma-butyrolacton (GBL) eller 1,4-butandiol (BDO). Den undgår også de typisk lave udbytter, der ses ved oxidation af tetrahydrofuran (THF). Den bruger en lettilgængelig aminosyre, gamma-aminosmørsyre (GABA), og natriumnitrit (NaNO2). Den skalerer meget pænt og kører uden for meget besvær. Derbruges ikke et eneste mistænkeligt kemikalie.
Sandmeyer-reaktionen bruger salpetersyre til at omdanne aminer til diazoniumsalte. Denne reaktion, som anvendes til at omdanne GABA til GHB, er vist i den første reaktion nedenfor. Alifatiske diazoniumsalte undergår hurtigt hydrolyse i nærvær af vand, hvorved der afgives nitrogengas og efterlades en hydroxylgruppe. Dette er vist i det andet trin. Som et resultat af disse reaktioner kan GABA omdannes til GHB i en one-pot-reaktion, der er nem at udføre.
Kør reaktionen.
Opstil en 2 L-kolbe, der står i isvand oven på en magnetomrører. Tilsætnu
Kør reaktionen.
Opstil en 2 L-kolbe, der står i isvand oven på en magnetomrører. Tilsætnu
- Tilsæt3 mol GABA (309,4 g).
- Tilsæt3 mol NaNO2 (207,0 g).
- Tilsæt700 ml vand (samlet volumen bliver ca. 1100 ml).
- Sæt en1" rørepind i, og begynd at røre.
- Fyld en500 ml trykudlignet tilsætningstragt med 3,3 mol HCl(aq) (385,0 g 31,25 %, 334,8 ml 31,25 %).
- Forsyn additionstragten med engasudløbsadapter, og udluft til det fri.
Begynd langsomt at dryppe saltsyren ned i blandingen. Dryp den ind med en konstant hastighed på ca. 1 dråbe hvert 2-5. sekund. Sæt farten op, efterhånden som tiden går, og udskift isen efter behov, men lad ikke udviklingen af den brune giftgas blive for kraftig. Efter ca. en time, når den sidste dråbe syre er tilsat, er det ikke nødvendigt at udskifte isen. Når reaktionen er færdig, skal du fortsætte med at ekstrahere. (normalt 24-36 timer senere)
Ekstraktion.
Der er mange muligheder for dette. Dette er stadig et igangværende arbejde, men efter ca. 20 kørsler kom jeg til at bruge dette arbejde. Du kan bruge ethylacetat (EtOAc), chloroform eller methylenchlorid (dichlormethan aka DCM) til at udføre ekstraktionerne med opløsningsmidler. Jeg har normalt brugt DCM, da det organiske lag falder ned i bunden af skilletragten.
1. Opsætning til en simpel destillation
Ekstraktion.
Der er mange muligheder for dette. Dette er stadig et igangværende arbejde, men efter ca. 20 kørsler kom jeg til at bruge dette arbejde. Du kan bruge ethylacetat (EtOAc), chloroform eller methylenchlorid (dichlormethan aka DCM) til at udføre ekstraktionerne med opløsningsmidler. Jeg har normalt brugt DCM, da det organiske lag falder ned i bunden af skilletragten.
1. Opsætning til en simpel destillation
a) Destillér, og smid de første 5-10 ml destillat ud, da det vil indeholde en del nitrogenoxider. Destillérså meget vand væk som muligt, stort set indtil natriumchlorid begynder at mætte det vandige lag og udfældes.
b) Resten af destillatet (ca. 700 ml) vil indeholde ca. 1 g GBL/10 ml.
c) Behandl resten af destillatet med NaHCO3 ved tilbagesvaling i 30 minutter.
d) Kog med ca. 5 % aktivt kul (dvs. 0,35 ml aktivt kul) (i forhold til opløsningens volumen) i 5-10 minutter.
e) Lad det køle af og filtrer, vask kullet med destilleret vand. Gem NaGHB'en.
2. Med resten af den vandige opløsning ekstraheres 5 gange med 625 ml DCM.
3. Destillér DCM'en væk (genbrug DCM'en!).
4 . Destillér GBL (under vakuum, hvis det er muligt).
5 . Reager med NaHCO3 og destilleret vand, og behandl med aktivt kul som før.
Typisk fremstilles 375 g NaGHB fra den opløsningsmiddelekstraherede GBL, hvoraf 100 g NaGHB fra det vandige destillat. Selvom omdannelsen er næsten kvantitativ (målt ved GC/MS), er det samlede udbytte normalt ca. 70 %.
3. Destillér DCM'en væk (genbrug DCM'en!).
4 . Destillér GBL (under vakuum, hvis det er muligt).
5 . Reager med NaHCO3 og destilleret vand, og behandl med aktivt kul som før.
Typisk fremstilles 375 g NaGHB fra den opløsningsmiddelekstraherede GBL, hvoraf 100 g NaGHB fra det vandige destillat. Selvom omdannelsen er næsten kvantitativ (målt ved GC/MS), er det samlede udbytte normalt ca. 70 %.
Last edited:
