- Joined
- Jun 24, 2021
- Messages
- 1,644
- Solutions
- 2
- Reaction score
- 1,753
- Points
- 113
- Deals
- 666
Informazioni generali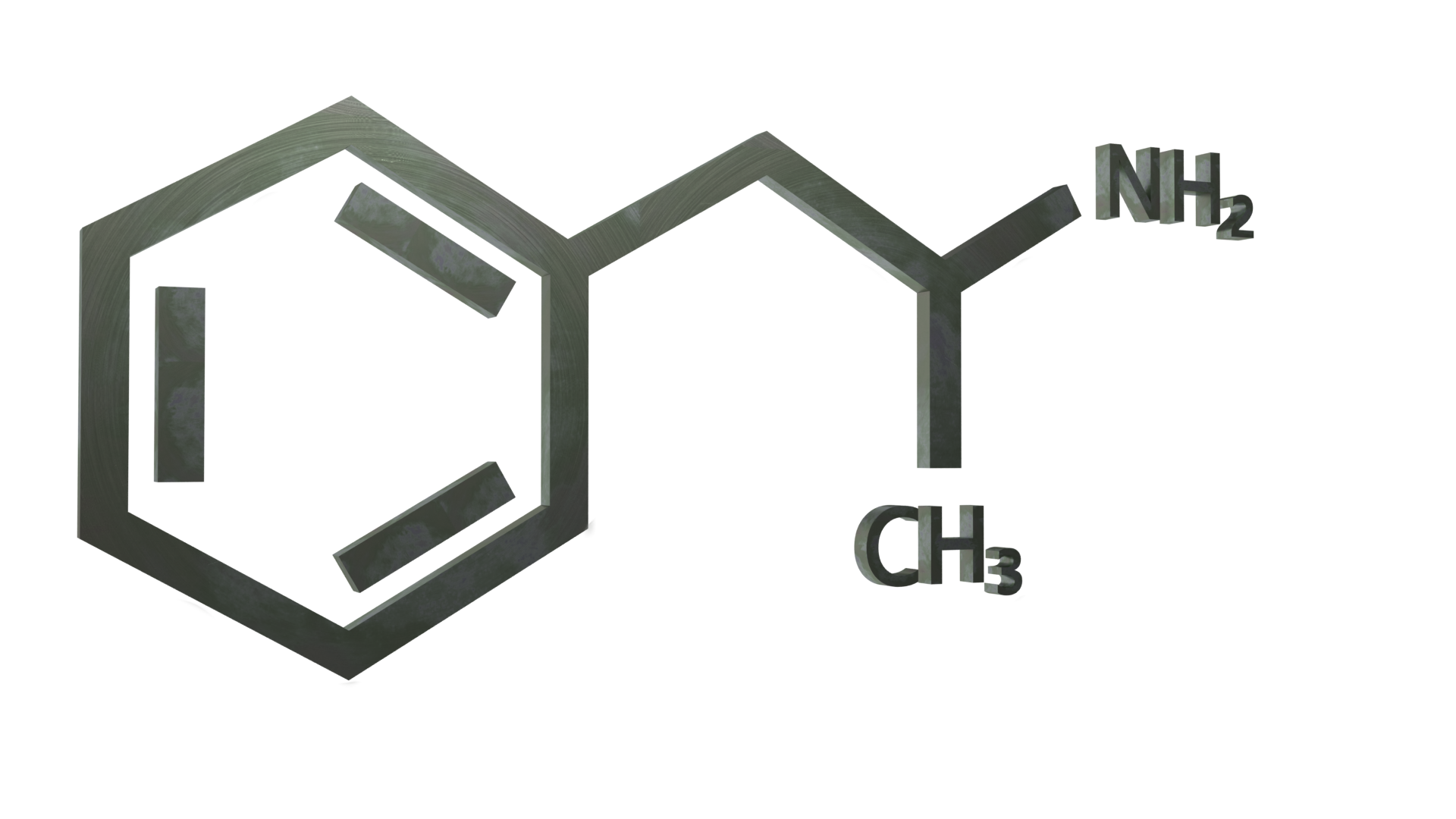
L'anfetamina (nota anche come alfa-metilfenetilamina, amfetamina e speed) è una sostanza stimolante classica della classe delle fenetilamine. È il composto capostipite delle anfetamine sostituite, un gruppo eterogeneo che comprende metanfetamina, MDMA, catinone e bupropione. Il meccanismo d'azione consiste nel promuovere il rilascio dei neurotrasmettitori dopamina e noradrenalina.
L'anfetamina, una sostanza scoperta oltre 100 anni fa, è una delle droghe controllate più limitate. In passato veniva utilizzata per una grande varietà di condizioni, ma la situazione è cambiata fino ad arrivare al momento in cui il suo uso è fortemente limitato. L'anfetamina, la cui formula chimica è alfa-metilfenetilammina, è stata scoperta nel 1910 e sintetizzata per la prima volta nel 1927. Dopo aver dimostrato di ridurre l'anestesia indotta da farmaci e di produrre eccitazione e insonnia, la miscela racemica di anfetamina fu registrata da Smith, Kline e French nel 1935. La struttura dell'anfetamina presenta un centro chirale ed esiste sotto forma di destro- e levo-isomeri. Il primo prodotto di Smith, Kline e French è stato approvato dalla FDA nel 1976.
Negli anni '30 fu venduto al banco con il nome di "Benzedrina" come decongestionante. Divenne ampiamente utilizzata per trattare una serie di disturbi come i postumi dell'alcol, la narcolessia, la depressione e l'obesità. Durante la Seconda Guerra Mondiale, l'anfetamina fu utilizzata per favorire la veglia dei soldati. Questo uso portò a una grande sovrapproduzione di anfetamina e tutte le eccedenze, dopo la fine della guerra, finirono nel mercato nero, dando inizio all'abuso. A causa dei problemi di dipendenza e di abuso, l'anfetamina è stata inserita nell'elenco delle sostanze controllate dalla "Convenzione sulle sostanze psicotrope" delle Nazioni Unite del 1971.
Oggi l'anfetamina è principalmente un farmaco da prescrizione utilizzato per trattare il disturbo da deficit di attenzione e iperattività (ADHD), la narcolessia e l'obesità. Inoltre, vede un diffuso uso illecito come agente di miglioramento delle prestazioni e sostanza ricreativa.
Proprietà fisiche
- Formula C9H13N
- Massa molare 135,210 g/mol
- Densità 0,936 g/cm3 a 25 °C
- Punto di fusione 11,3 °C (52,3 °F)
- Punto di ebollizione 200-203 °C (397 °F) a 760 mmHg
Proprietà chimiche
La base libera dell'anfetamina è un liquido oleoso volatile incolore con un caratteristico odore di "pesce" e un sapore acre e bruciante, scarsamente solubile in acqua, prontamente solubile in solventi organici, punto di ebollizione 200-203 °C.
L'anfetamina è un omologo metilico del neurotrasmettitore dei mammiferi, la fenetilamina, con formula chimica C9H13N. L'atomo di carbonio adiacente all'ammina primaria è un centro stereogenico e l'anfetamina è composta da una miscela racemica 1:1 di due enantiomeri. Questa miscela racemica può essere separata nei suoi isomeri ottici: levoanfetamina e destroanfetamina (isomeri l e d). I sali solidi di anfetamina frequentemente preparati includono cloridrato, fosfato e solfato di anfetamina. Il solfato di destroamfetamina è il sale enantiopuro più comune. L'anfetamina è anche il composto capostipite della sua classe strutturale, che comprende una serie di derivati psicoattivi.
Metodi di sintesi
Esiste un elenco dei metodi di sintesi dell'anfetamina più diffusi. Tutte hanno vantaggi e svantaggi propri. La sintesi non selettiva più diffusa è la riduzione P2NP, che può essere effettuata con amalgama di alluminio(Al). Inoltre, è possibile ridurre con NaBH4, LAH o idrogeno gassoso con un catalizzatore (PtO2 o Pd/C) e un eccesso di pressione. Il P2NP può essere sintetizzato per semplice condensazione del nitroetano con la benzaldeide.
Uno dei metodi più comuni di produzione clandestina di anfetamina è la reazione di Leuckart, che consiste nella condensazione del fenilacetone (fenil-2-propanone, P2P) con formammide o formiato di ammonio in presenza di acido formico e successiva idrolisi acida della N-formilanfetamina risultante.
La mfetamina può essere preparata anche per aminazione riduttiva del fenilacetone (P2P) in presenza di un catalizzatore metallico. La reazione procede con la formazione di un'imina intermedia. Esempi di reazione sono: Riduzione catalitica eterogenea del fenilacetone con ammoniaca. Il catalizzatore può essere palladio su carbonio, ossido di platino o nichel Raney. Riduzione con amalgama di alluminio, zinco o magnesio.
Se necessario, gli stereoisomeri destroamfetamina e levoamfetamina possono essere separati con acido tartarico. Inoltre, è stato pubblicato un metodo per la sintesi stereoselettiva della destroamfetamina, che consiste nell'aminazione riduttiva del fenilacetone con S-α-metilbenzilammina. L'immina ottenuta viene ridotta con Pd/C o nichel Raney e ricristallizzata come cloridrato. Il gruppo N-benzilico viene poi idrogenato in presenza di palladio su carbone per formare destroamfetamina di elevata purezza ottica.
Analisi e purificazione
In qualsiasi metodo di sintesi dell'anfetamina vengono utilizzate sostanze tossiche e pericolose. Esistono due metodi di purificazione dell'anfetamina : il "lavaggio del prodotto" e il metodo più avanzato "estrazione acido-base".
Il lavaggio della droga è una parte essenziale e finale di quasi tutte le sintesi. A volte viene ripetuto più volte. Il metodo è alla portata di tutti, non richiede competenze, può migliorare significativamente la qualità del prodotto e della presentazione. Il metodo è ideale per piccole quantità. Il lavaggio è indicato per i residui di P2NP, alcali, acidi e così via. Il lavaggio non rimuove i contaminanti (acetaminofene, caffeina, ecc.) e i sali di mercurio.
Il metodo più accessibile, e quindi più semplice, è il lavaggio dell'anfetamina con alcol isopropilico (IPA). Più difficile da usare è l'acetone anidro. L'IPA non contiene acqua e quindi non scioglie il sale di anfetamina. La chiave del successo del processo è la mancanza di acqua. È necessario per evitare la dissoluzione dell'anfiteatro con sostanze inquinanti, perché saranno buttate via.
L' estrazione acido-base (ABE), come metodo di purificazione, consente di ottenere un farmaco di alta qualità. Il metodo è valido grazie all'utilizzo di reagenti, strumenti e apparecchiature disponibili.
L'anfetamina viene tagliata in modo inaccettabile da caffeina, amido, nootropi come la cinnarizina e il piracetam, a-PVP, metanfetamina e altri stimolanti e sostanze da farmacia. Esistono diversi metodi per controllare l'anfetamina. Il metodo più popolare e più semplice è quello dei reagenti per il test delle droghe. Potete leggere gli altri metodi nel protocollo di valutazione dell'anfetamina.
Sono disponibili immagini di diversi campioni di anfetamina dopo i test con i reagenti.
Effetti e dosaggio
Gli effetti soggettivi includono stimolazione, aumento della concentrazione, aumento della motivazione, aumento della libido, soppressione dell'appetito ed euforia. Di solito viene assunta per via orale, ma può anche essere insufflata, iniettata o somministrata per via rettale. Le dosi più basse tendono ad aumentare la concentrazione e la produttività, mentre quelle più elevate tendono ad aumentare la socievolezza, il desiderio sessuale e l'euforia.
L'anfetamina ha un elevato potenziale di abuso. L'uso cronico (cioè con dosi elevate e somministrazioni ripetute) è associato a ridosaggio compulsivo, tolleranza crescente e dipendenza psicologica. Inoltre, l'abuso è stato collegato a una serie di condizioni di salute, in particolare a problemi cardiovascolari come l'ipertensione e l'aumento del rischio di ictus. Si consiglia vivamente di ricorrere a pratiche di riduzione del danno se si fa uso di questa sostanza.
[SPOILER=Effetti fisici]
Stimolazione - Si dice che l'anfetamina sia molto energica e stimolante. Può incoraggiare attività fisiche come ballare, socializzare, correre o pulire. Il particolare stile di stimolazione che l'anfetamina produce può essere descritto come forzato. Ciò significa che, a dosaggi più elevati, diventa difficile o impossibile stare fermi. Si verificano serramenti della mandibola, scosse corporee involontarie e vibrazioni, con conseguente tremolio estremo di tutto il corpo, instabilità delle mani e una generale perdita del controllo motorio fine. Tutto ciò viene sostituito da una leggera stanchezza e da un esaurimento generale durante la fase di compensazione dell'esperienza.
-
Sensazioni corporee spontanee - Lo "sballo corporeo" dell'anfetamina può essere descritto come una moderata sensazione di formicolio euforico che coinvolge tutto il corpo. Questa sensazione mantiene una presenza costante che aumenta costantemente con l'inizio e raggiunge il suo limite una volta raggiunto il picco.
-
Euforia fisica
-
Battito cardiaco anomalo
-
Aumento della frequenza cardiaca
-
Aumento della pressione sanguigna - di circa 30 mmHg di sistolica e 20 mmHg di diastolica, da parte di utenti ingenui che hanno assunto 40 mg di d-AMP.
-
Soppressione dell'appetito
-
Broncodilatazione
-
Disidratazione
-
Secchezza delle fauci
-
Minzione frequente
-
Difficoltà a urinare
-
Aumento della temperatura corporea
-
Aumento della sudorazione
-
Mania - L'anfetamina può produrre mania in individui geneticamente predisposti, come quelli che rientrano nello spettro del disturbo bipolare o della schizofrenia. Dosi più elevate e privazione del sonno sembrano aumentare il rischio.
-
Nausea - Può essere attenuata mangiando prima della somministrazione e durante l'esperienza.
-
Dilatazione delle pupille - Questo effetto si verifica solo a dosaggi comuni o elevati ed è più evidente durante il comedown.
-
Sincope riflessa
-
Potenziamento della resistenza
-
Digrignamento dei denti - Il digrignamento dei denti può essere presente a dosi elevate. Tuttavia, è meno intenso di quello dell'MDMA.
-
Disfunzione erettile temporanea
-
Vasocostrizione - L'uso di anfetamine provoca la costrizione dei vasi sanguigni, con conseguente insufficienza di sangue in alcune parti del corpo. Questo può causare sensazioni di formicolio o dolore, sensazione di freddo, intorpidimento, pallore o cambiamenti del colore della pelle, soprattutto nelle dita delle mani e dei piedi.
[/SPOILER]
[SPOILER=Effetto visivo]
-
Gli effetti visivi dell'anfetamina sono inconsistenti e si manifestano solo in modo lievemente evidente alle dosi più elevate. Sono in qualche modo paragonabili alle visioni deliranti e si verificano più facilmente nelle aree più scure.
[/SPOILER]
[SPOILER=Distorsioni]
-
Deriva - Questo effetto è di solito sottile e appena percettibile e si verifica solo a dosaggi più elevati o in combinazione con la cannabis. In genere si tratta di una deriva di livello 1-2.
- Alterazione della luminosità - L'anfetamina può far sembrare gli spazi più luminosi grazie ai suoi effetti di dilatazione delle pupille.
- Traccianti - Questo effetto è impercettibile a bassi dosaggi. È più pronunciato con dosaggi maggiori e soprattutto quando si è privati del sonno, cosa che d'altra parte può essere facilmente provocata da altri effetti di questa sostanza. Trasformazioni - Questo effetto si verifica molto raramente, e in genere solo quando l'utente ha assunto dosi elevate, sta scendendo o è stato sveglio per periodi insolitamente lunghi. Quando si verificano sono di solito molto lievi.
[/SPOILER]
[SPOILER=Stati allucinatori]
-
Trasformazioni - Questo effetto si verifica molto raramente, in genere solo quando l'utente ha assunto dosi elevate, sta scendendo o è rimasto sveglio per periodi insolitamente lunghi. Di solito sono molto lievi quando si verificano.
-
Geometria - Questo effetto viene riferito da alcuni consumatori di anfetamine e sostanze affini, in genere alle dosi più elevate quando si cerca di dormire. Può essere descritto nelle sue varianti come semplicistico, algoritmico, sintetico, scarsamente illuminato, multicolore, lucido, dai bordi netti, ingrandito, liscio, angolare, immersivo e progressivo. In genere si verifica al livello 3, ma può progredire al 4 e al 5 se combinato con sostanze come la cannabis o il DXM.
[/SPOILER]
[SPOILER=Effetti cognitivi]
- Potenziamento dell'analisi
- Euforia cognitiva
- Ridosaggio compulsivo
- Inflazione dell'ego
- Soppressione delle emozioni - Questo effetto è tipicamente più intenso a dosi leggere e comuni, ed è più comunemente riportato dall'uso medico piuttosto che da quello ricreativo.
- Aumento dell'attenzione - Questo effetto è più efficace a dosi basse o moderate, poiché qualsiasi dose superiore di solito compromette la concentrazione.
- Aumento della libido - Sebbene l'uso di anfetamine possa causare sensazioni di miglioramento sessuale, la costrizione dei vasi sanguigni può rendere difficile ottenere o mantenere l'erezione.
- Aumento dell'apprezzamento della musica
- Irritabilità - È più probabile che si verifichi a dosi elevate.
- Miglioramento della memoria
- Aumento della motivazione
- Psicosi - Questo effetto si verifica solo in individui predisposti, o dopo un uso cronico e ad alta frequenza, o a causa della privazione del sonno.
- Soppressione della suggestionabilità
- Accelerazione del pensiero
- Organizzazione del pensiero
- Distorsione del tempo - Si può descrivere come l'esperienza del tempo che accelera e passa molto più velocemente di quanto non faccia di solito da sobrio.
- Veglia
[/SPOILER]
[SPOILER=Effetti collaterali]
Gli effetti che si verificano durante il periodo di sospensione di un'esperienza con gli stimolanti sono generalmente negativi e spiacevoli rispetto a quelli che si sono verificati durante il picco. Questo fenomeno viene spesso definito "comedown" e si verifica a causa della deplezione dei neurotrasmettitori. I suoi effetti includono comunemente:
- Ansia - In alcuni consumatori l'ansia può raggiungere livelli gravi durante il comedown.
- Soppressione dell'appetito
- Affaticamento cognitivo
- Depressione
- Aumento della frequenza cardiaca - Mentre la concentrazione ematica di anfetamina e la maggior parte degli effetti soggettivi sono massimi circa 3 ore dopo la somministrazione, la frequenza cardiaca raggiunge un picco molto più tardi, a 10 ore dalla somministrazione.
- Irritabilità
- Soppressione della motivazione
- Gambe irrequiete
- Paralisi del sonno - Alcuni utenti notano paralisi del sonno dopo aver assunto anfetamina.
- Soppressione dei sogni
- Decelerazione del pensiero
- Veglia - L'insonnia che segue una serie ripetuta di dosi di anfetamina può durare per più di un giorno in alcuni consumatori.
- Soppressione della motivazione - Le esperienze possono variare da una lieve demotivazione a stati estremi di disinteresse. Questo effetto è più evidente a dosi comuni e pesanti.
[/SPOILER]
Farmacologia
L'anfetamina esercita i suoi effetti comportamentali aumentando l'attività di segnalazione dei neurotrasmettitori noradrenalina e dopamina nelle vie della ricompensa e della funzione esecutiva del cervello. Gli effetti rinforzanti e motivazionali dell'anfetamina sono dovuti principalmente all'aumento dell'attività dopaminergica nella via mesolimbica.
Gli effetti euforici e di stimolazione locomotoria dell'amfetamina dipendono dall'entità e dalla velocità con cui aumenta le concentrazioni sinaptiche di dopamina e noradrenalina nello striato.
È un potente agonista completo del recettore 1 associato alle amine in tracce (TAAR1) e interagisce con il trasportatore vescicolare di monoammine 2 (VMAT2). L'azione combinata su TAAR1 e VMAT2 determina un aumento delle concentrazioni di dopamina e noradrenalina nelle sinapsi, stimolando l'attività neuronale.
La destroanfetamina è un agonista più potente del TAAR1 rispetto alla levoanfetamina. Di conseguenza, la destroanfetamina produce una maggiore stimolazione del SNC rispetto alla levoanfetamina, all'incirca tre o quattro volte di più, ma la levoanfetamina ha effetti cardiovascolari e periferici leggermente più forti.
La biodisponibilità esatta dell'anfetamina non è nota, ma si ritiene che sia superiore al 75% per bocca e più elevata per iniezione o somministrazione intranasale. L'assorbimento e l'escrezione possono dipendere dal pH. Essendo una base debole, più l'ambiente è basico più il farmaco si trova in forma lipidica e l'assorbimento attraverso le membrane cellulari ricche di lipidi è altamente favorito. Il picco di risposta dell'anfetamina si verifica 1-3 ore dopo la somministrazione orale e circa 15 minuti dopo l'iniezione. L'assorbimento completo dell'anfetamina avviene solitamente dopo 4-6 ore. La forma basica viene assorbita più facilmente nell'intestino e meno facilmente eliminata dai reni, aumentando potenzialmente la sua emivita. Viene eliminata dai reni attraverso l'escrezione e una piccola quantità viene eliminata dagli enzimi epatici.
Dati sul mercato illegale
Offerta globale di stimolanti di tipo anfetaminico (ATS)
Nel 2020 è stato sequestrato un quantitativo record di oltre 525 tonnellate di ATS, che rappresenta un aumento del 15% rispetto all'anno precedente e continua la tendenza all'aumento osservata nel periodo 2010-2020.Lequantità di metanfetamina sequestrate sono quintuplicate in questo periodo di 10 anni, le quantità di anfetamina sequestrate sono quasi quadruplicate elequantità di "ecstasy" sequestrate sono più che triplicate.
L'uso di anfetamine ha continuato ad aumentare, ma ci sono segnali di diminuzione della domanda di trattamento nel 2020. Sulla base delle risposte autodichiarate alle indagini sulla popolazione generale, si stima che 34 milioni di persone di età compresa tra i 15 e i 64 anni, pari allo 0,7% della popolazione mondiale, abbiano fatto uso di anfetamine nell'ultimo anno e che 20 milioni (0,4%) abbiano fatto uso di sostanze del tipo "ecstasy". Alcuni di questi consumatori hanno fatto uso di entrambi i tipi di sostanze. Le due anfetamine più comunemente utilizzate sono l'anfetamina e la metanfetamina.
La stima globale del consumo di anfetamine era simile nel 2010, con 33 milioni di consumatori nell'ultimo anno o lo 0,7% della popolazione di età compresa tra 15 e 64 anni. Tuttavia, queste stime devono essere interpretate con cautela a causa della mancanza di dati provenienti dai principali Paesi consumatori in Asia, dove altri indicatori di mercato, come i sequestri e i prezzi, suggeriscono un'espansione nell'ultimo decennio. Le informazioni qualitative basate sulle percezioni delle tendenze riportate dagli esperti nazionali all'UNODC mostrano un continuo aumento sia in termini di uso di anfetamine che di numero di persone in trattamento per anfetamine nell'ultimo decennio. Tuttavia, i dati relativi al 2020 mostrano che questa tendenza all'aumento si è arrestata e che il numero di persone in trattamento per anfetamine potrebbe essere diminuito, coerentemente con una diminuzione generale del trattamento a seguito della pandemia COVID-19. e Le tendenze derivate da tali informazioni qualitative sono coerenti con gli indicatori di offerta disponibili, come i prezzi e i sequestri, che indicano una continua espansione globale del mercato delle anfetamine. Le informazioni qualitative di questo tipo soffrono di limiti metodologici, ma hanno il vantaggio di prendere in considerazione studi su piccola scala e osservazioni di esperti relative a Paesi in cui le indagini sul consumo di droga non vengono effettuate regolarmente. Le informazioni qualitative sulle tendenze del consumo di "ecstasy" sono state riportate dai Paesi in diverse categorie prima dell'implementazione da parte dell'UNODC del suo nuovo strumento di raccolta dati (il questionario aggiornato per le relazioni annuali, entrato in uso nel 2020), pertanto le relazioni qualitative sulle tendenze del consumo di "ecstasy" sono limitate al periodo 2019-2020. Questi rapporti suggeriscono un moderato aumento a livello globale. Allo stesso tempo, gli studi condotti nei Paesi in cui l'"ecstasy" è utilizzata in ambito ricreativo suggeriscono che il consumo di "ecstasy" è diminuito più di ogni altra droga durante la pandemia in quei Paesi. Anche l'analisi delle acque reflue, sebbene limitata geograficamente all'Europa, al Nord America e ad alcune parti dell'Asia e dell'Oceania, suggerisce che l'uso di "ecstasy" è diminuito tra il 2019 e il 2020 più dell'uso di anfetamine. Nella maggior parte delle località analizzate è stato riscontrato un aumento del consumo di MDMA, mentre in una leggera maggioranza di queste località è stato rilevato un aumento del consumo di anfetamine e una diminuzione di quello di metanfetamine. I primi dati di analisi delle acque reflue del 2021 suggeriscono un aumento generale del consumo di anfetamine nella maggior parte delle località monitorate dal gruppo Sewage Analysis CORe, la maggior parte delle quali si trova in Europa, tra il 2020 e il 2021; un aumento e una diminuzione del consumo di metanfetamine in circa lo stesso numero di località; e una continua diminuzione del consumo di MDMA in un'ampia maggioranza di località.
