G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,659
- Solutions
- 3
- Reaction score
- 2,734
- Points
- 113
- Deals
- 1
Inledning.
Den här filen handlar om syntesen av GHB och relaterade föreningar. Det är mycket farligt att försöka sig på en syntes av GHB utan rätt kunskap om praktisk organisk kemi. Det allra enklaste sättet att framställa GHB är genom hydrolys av motsvarande lakton (en cyklisk intramolekylär ester) till den önskade hydroxisyran. Esterhydrolys kan göras på två sätt: En syrakatalyserad reaktion eller en baskatalyserad reaktion. Denbaskatalyserade reaktionen är vårt val här eftersom reaktionen inte är reversibel som den syrakatalyserade, och därför kommer vi att få högre utbyten, och vi kommer att få natriumsaltet av GHB, eftersom den fria syran inte är stabil och omedelbart kommer att cykliseras till gamma-butyrolakton igen.
Omvandling avgamma-butyrolakton till natriumgamma-hydroxibutyrat (Na-GHB).
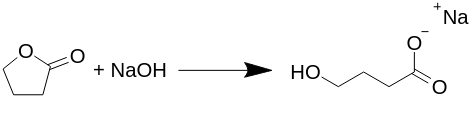
Reaktionen fortskrider ekvimolärt (samma antal av varje molekyl reagerar), och det finns inga biprodukter som produceras i denna reaktion, såsom vätgas, vatten eller något annat som föreslås i flera andra texter. Alla publicerade beredningar av GHB, eller mer korrekt Na-GHB, återflödar butyrolakton med natriumhydroxid i olika lösningsmedel, vanligtvis i vattenhaltig alkohol, men detta är inte nödvändigt.
Fysikaliska/kemiska egenskaper.
gamma-butyrolakton.
Molvikt 86,09; mp -43,53 °C; bp 204°C; d 1,12 g/ml
CAS-nr: [96-48-0]
Blandbar med vatten, löslig i metanol, etanol, aceton, eter, bensen
LD50: 1720 mg/kg (oralt, mus) 1540 mg/kg (oralt, råtta)
Användningsområden: Lösningsmedel, färgborttagningsmedel, kondensatorelektrolyt, i organisk kemi
Synonymer: GBL, BLO, butyrolakton, gamma-hydroxismörsyra-lakton, 1,2-butanolid, 1,4-butanolid, 4-butanolid, 2-oxanolon, tetrahydro-2-furanon, dihydro-2(3H)-furanon.
Sodium GHB.
Molvikt 126,09; mp 145-146 °C
CAS-nr: [502-85-2]
LD50:2700 mg/kg (oralt, råtta)
Synonymer: Gamma-OH, natriumoxybat, natriumgamma-oxybutyrat, Somatomax PM, Wy-3478, NSC-84223, Somsanit, Anetamin.
Kalium GHB.
Molvikt: 142,20
Kalcium GHB.
Molvikt246,16; mp 164-166 °C, 166-168 °C.
Magnesium GHB.
Molvikt 230,39; mp (vattenfri) 172-174 °C; tetrahydrat 118-120 °C; pentahydrat 76-78 °C.
Molvikt 86,09; mp -43,53 °C; bp 204°C; d 1,12 g/ml
CAS-nr: [96-48-0]
Blandbar med vatten, löslig i metanol, etanol, aceton, eter, bensen
LD50: 1720 mg/kg (oralt, mus) 1540 mg/kg (oralt, råtta)
Användningsområden: Lösningsmedel, färgborttagningsmedel, kondensatorelektrolyt, i organisk kemi
Synonymer: GBL, BLO, butyrolakton, gamma-hydroxismörsyra-lakton, 1,2-butanolid, 1,4-butanolid, 4-butanolid, 2-oxanolon, tetrahydro-2-furanon, dihydro-2(3H)-furanon.
Sodium GHB.
Molvikt 126,09; mp 145-146 °C
CAS-nr: [502-85-2]
LD50:2700 mg/kg (oralt, råtta)
Synonymer: Gamma-OH, natriumoxybat, natriumgamma-oxybutyrat, Somatomax PM, Wy-3478, NSC-84223, Somsanit, Anetamin.
Kalium GHB.
Molvikt: 142,20
Kalcium GHB.
Molvikt246,16; mp 164-166 °C, 166-168 °C.
Magnesium GHB.
Molvikt 230,39; mp (vattenfri) 172-174 °C; tetrahydrat 118-120 °C; pentahydrat 76-78 °C.
Laboratorieförfaranden för syntes av GHB-salter.
Följ de vanliga säkerhetsrutinerna för laboratoriet. Bär labbrock och skyddsglasögon. Du kommer att arbeta med heta kaustiska lösningar och lösningsmedel! Var medveten om de risker som är förknippade med tillverkningen av GHB! Arbeta aldrig ensam!
Sodium GHB.
Procedur:
Lös upp 130 gram (3,25 mol) ren natriumhydroxid i 400 ml destillerat vatten i en 1000 ml trehalsad rundkolv under omrörning. Upplösningen är exoterm och lösningen kommer att värmas upp. Ett kallt vattenbad kan användas för att reglera temperaturen. När allt har lösts upp till en klar lösning, tillsätt långsamt 250 ml (280 g, 3,25 mol) gamma-butyrolakton i 50 ml portioner under god omrörning. Användning av dropptratt rekommenderas. Tillsatsen av gamma-butyrolakton till natriumhydroxidlösningen är också exoterm, och om den tillsätts för snabbt kommer lösningen att börja koka, och det vill vi inte. Håll koll på temperaturen med en nedsänkt termometer. Tillsatsen av gamma-butyrolakton kommer att ta någonstans mellan 20-30 minuter. När allt har tillsatts låter du blandningen reagera i ytterligare 10 minuter under sporadisk omrörning.
Nu är det dags att se om reaktionen har slutförts genom att kontrollera pH-värdet med ett universellt pH-papper. Vi siktar på ett pH-värde på 7-8. Om det är för högt (pH > 8), tillsätt då 10 ml gamma-butyrolakton och låt reagera ytterligare några minuter. Om pH-värdet är för lågt (pH < 7), tillsätt några ml koncentrerad NaOH-akv. lösning. Fortsätt på detta sätt tills pH-värdet ligger inom önskade gränser.
Lösningen är helt klar och smakar något salt. Den kan vara något gulfärgad, men inte mycket om tillräckligt ren butyrolakton användes (destillation av laktonen före användning tar hand om detta problem, b.p. 204 °C). Om en syra används för att neutralisera en alltför basisk lösning (i stället för att tillsätta mer lakton) kan kristaller av syrans natriumsalt fällas ut i lösningen och smaken försämras kraftigt. Den slutliga lösningen kommer att vara cirka 750 ml, 50% NaGHB. Lösningen kan koncentreras (genom att koka bort överflödigt vatten) till ~600 ml utan att den kristalliserar i rumstemperatur, men om den koncentreras så långt som till ~500 ml kommer den alltid att stelna.
Nu är det dags att se om reaktionen har slutförts genom att kontrollera pH-värdet med ett universellt pH-papper. Vi siktar på ett pH-värde på 7-8. Om det är för högt (pH > 8), tillsätt då 10 ml gamma-butyrolakton och låt reagera ytterligare några minuter. Om pH-värdet är för lågt (pH < 7), tillsätt några ml koncentrerad NaOH-akv. lösning. Fortsätt på detta sätt tills pH-värdet ligger inom önskade gränser.
Lösningen är helt klar och smakar något salt. Den kan vara något gulfärgad, men inte mycket om tillräckligt ren butyrolakton användes (destillation av laktonen före användning tar hand om detta problem, b.p. 204 °C). Om en syra används för att neutralisera en alltför basisk lösning (i stället för att tillsätta mer lakton) kan kristaller av syrans natriumsalt fällas ut i lösningen och smaken försämras kraftigt. Den slutliga lösningen kommer att vara cirka 750 ml, 50% NaGHB. Lösningen kan koncentreras (genom att koka bort överflödigt vatten) till ~600 ml utan att den kristalliserar i rumstemperatur, men om den koncentreras så långt som till ~500 ml kommer den alltid att stelna.
Beredning av natrium-GHB med hjälp av natriumbikarbonat (bakpulver, NaHCO3).
Tillsätt 273 g NaHCO3 (3,25 mol) till 1125 ml destillerat vatten i en trehalsad kolv med rund botten. Låt lösningen långsamt koka upp under omrörning med en glasstav eller liknande. All bakpulver kommer att lösas upp. Koldioxid kommer att avgå från lösningen när den börjar koka. Detär natriumbikarbonatet som bryts ned till en något starkare bas, natriumkarbonat.
Sänk värmen till lätt kokning och tillsätt långsamt 250 ml gamma-butyrolakton (280 g, 3,25 mol). Tillsatsen är inte omedelbart exoterm, som vid natriumhydroxidsyntesen. Låt lösningen koka lätt i 30 minuter. Kontrollera pH-värdet med ett universellt pH-papper. Vi siktar på ett pH-värde runt 7, men allt mellan 6 och 8 är helt säkert. Om pH-värdet är för högt tillsätter du lite mer GBL och fortsätter att återflöda.
Lösningen blir helt klar och ska vara helt färglös. Om den inte är helt färglös, dvs. om något oren butyrolakton har använts och lösningen har fått en ljusgul färg, tillsätt ca 100 mL aktivt kol. Låt detta koka i 10 minuter. Kyl lösningen, filtrera och tvätta det aktiva kolet två eller tre gånger med 50 ml kallt vatten. 410 g NaGHB kommer att framställas i denna syntes. Denna lösning kan koncentreras till ca 50% NaGHB innan den börjar kristallisera. Om du vill ha ett pulver, värm tills lösningens temperatur når 150 °C, häll sedan upp på en kyld Pyrex-skål och låt den svalna och stelna. Denna syntes är perfekt för användning där det inte finns någon natriumhydroxid av ACS-, livsmedels- eller elektronikkvalitet tillgänglig.
Lösningen blir helt klar och ska vara helt färglös. Om den inte är helt färglös, dvs. om något oren butyrolakton har använts och lösningen har fått en ljusgul färg, tillsätt ca 100 mL aktivt kol. Låt detta koka i 10 minuter. Kyl lösningen, filtrera och tvätta det aktiva kolet två eller tre gånger med 50 ml kallt vatten. 410 g NaGHB kommer att framställas i denna syntes. Denna lösning kan koncentreras till ca 50% NaGHB innan den börjar kristallisera. Om du vill ha ett pulver, värm tills lösningens temperatur når 150 °C, häll sedan upp på en kyld Pyrex-skål och låt den svalna och stelna. Denna syntes är perfekt för användning där det inte finns någon natriumhydroxid av ACS-, livsmedels- eller elektronikkvalitet tillgänglig.
Kalium GHB.
Använd etanolsyntesen som beskrivs ovan för natrium-GHB, men byt ut de 130 g NaOH mot 182 g KOH (denna beräkning baseras på den tyngre K-atomen och den högre vattenhalten i KOH jämfört med NaOH). Genom att använda KOH får användare av K-GHB det kaliumtillskott som av vissa sägs behövas i samband med administrering av GHB. Tänk på att (pulveriserad) K-GHB är något mindre aktiv (i vikt) än Na-GHB, eftersom K-jonen är tyngre än Na-motsvarigheten. Skillnadermellan K-GHB och Na-GHB är att K-saltet är mer lösligt i vatten än Na-saltet, och smaken är mer som salt / lakrits istället för salt / tvålsmak av Na-GHB.
Kalcium GHB.
74 g analytiskt ren kalciumhydroxid suspenderas i 200 ml destillerat vatten. 160 ml 4-butyrolakton tillsätts i portioner (varje portion ca 5 till 10 ml) och under omrörning till denna suspension vid rumstemperatur. Efter tillsats av 20 ml värms reaktionsblandningen upp till ca 50-60 °C. Tillsatsen av 4-butyrolakton kontrolleras så att temperaturen förblir mellan ca 50 °C och 60 °C, vilket tar ca 1 timme. Under denna tid har kalciumhydroxiden lösts upp praktiskt taget fullständigt. Reaktionsmaterialet är förorenat med en lätt rostgul fällning. Det förtunnas med 300 ml metanol, får stå i fyra timmar och filtreras sedan genom ett veckat filter. Det klara filtratet behandlas försiktigt med 200 ml aceton på så sätt att efter varje portion aceton som orsakar en fällning, ges tid för fällningen att lösa sig igen. En vattenklar lösning erhålls, som placeras för kristallisation. Efter två timmars uppställning börjar färglösa kristaller att avsättas. I detta tillstånd påskyndas kristallisationen genom kontinuerlig tillsats av aceton (totalt 100 ml). Kristallisationstiden är 24 timmar. Kristallerna sugs av och tvättas först med 50 ml metanol och sedan ytterligare med 60 ml aceton. Kristallerna torkas vid temperaturer från ca 60 °C till 80 °C i ett torkskåp. Utbyte: 230 g. Smältpunkt 166-168 °C. (omedelbart). Produkten är det vattenfria, icke hygroskopiska kalciumsaltet av 4-hydroxismörsyran. Det är lösligt som önskat i vatten, den vattenhaltiga lösningen har ett pH-värde på 7 till 7,5. Saltet kan lagras så länge som önskas och förändras inte i luft. Inte ens vid lagring attraheras något vatten från luften.
Återstoden kristalliserar till en massa färglösa kristaller, som torkas vid temperaturer från ca 60 °C till 80 °C. Utbyte: ca 105 g. Smältpunkt 164-166 °C. Produkten är Di-(4-hydroxibutyric) kalcium. Den omkristalliseras genom upplösning i lite metanol, följt av tillsats av aceton till grumlighet, och kristallisering i kyla.
I stället för metanol kan även etanol och isopropanol användas för omkristallisering med samma framgång. Utan att använda vattenhaltiga alkoholer som omkristallisationsmedium eller som tillsats vid omkristallisation och rening erhålls inga stabila och i synnerhet inga icke hygroskopiska kalciumsalter. Vattenhalten i alkoholerna bör vara från cirka 3-10 volymprocent. Den så erhållna slutprodukten löser sig lätt i vatten, är inte hydroskopisk och har en behaglig aromatisk lukt.
Återstoden kristalliserar till en massa färglösa kristaller, som torkas vid temperaturer från ca 60 °C till 80 °C. Utbyte: ca 105 g. Smältpunkt 164-166 °C. Produkten är Di-(4-hydroxibutyric) kalcium. Den omkristalliseras genom upplösning i lite metanol, följt av tillsats av aceton till grumlighet, och kristallisering i kyla.
I stället för metanol kan även etanol och isopropanol användas för omkristallisering med samma framgång. Utan att använda vattenhaltiga alkoholer som omkristallisationsmedium eller som tillsats vid omkristallisation och rening erhålls inga stabila och i synnerhet inga icke hygroskopiska kalciumsalter. Vattenhalten i alkoholerna bör vara från cirka 3-10 volymprocent. Den så erhållna slutprodukten löser sig lätt i vatten, är inte hydroskopisk och har en behaglig aromatisk lukt.
MagnesiumGHB .
60 g magnesiumhydroxid (analytisk kvalitet) suspenderas i 200 ml kranvatten under omrörning. I en stråle och under omrörning blandas 160 ml butyrolakton i denna suspension. Därefter upphettas blandningen på ett vattenbad under 6 timmar under omrörning i en 2-litersflaska. Magnesiumhydroxiden löses praktiskt taget fullständigt. Kolven får stå över natten, medan föroreningar avsätts och lösningen dekanteras utan ansträngning från föroreningsavsättningen. Det vattenklara dekantatet omrörs inledningsvis med 100 ml aceton i 10 minuter. Den färglösa sirapsliknande vätskan, som nu blivit mer trögflytande, blandas åter med 100 ml aceton enligt beskrivningen ovan, acetonen avlägsnas åter genom dekantering och den ganska trögflytande, färglösa sirapen får stå i rumstemperatur i ca 2 till 4 timmar. Den stelnar till en färglös kristallmassa, som finfördelas i en mortel och torkas i flera timmar i luft. Smältpunkt 76 °C till 78 °C. Utbyte: 314 g i analytiskt ren form.
Detta magnesiumsalt innehåller ca 5 mol hydratiseringsvatten. Det är inte hydroskopiskt, är stabilt och kan lagras under godtyckligt långa tider. Genom torkning under flera timmar vid 40 °C till 50 °C förlorar det en del av sitt kristallvatten (1 mol) och smälter sedan vid 118 °C till 120 °C. Vattenfri magnesium-4-hydroxibutyrat kan framställas genom att vatten avlägsnas genomsublimering och/eller indunstning av vatten under minskat partialtryck av vatten och vid förhöjd temperatur, eller genom kristallisation från en lösning som innehåller ett organiskt lösningsmedel. Det vattenfria saltet smälter vid 172-174 °C. Den kemiska analysen visar 10,50 vikt% magnesium (beräknat 10,55 vikt% magnesium). Alla modifieringar är icke hygroskopiska och stabila under lagring. 1 g av magnesiumsaltet löser sig i 2 ml vatten vid rumstemperatur, pH i vattenlösningen är 7. Det löser sig lätt i vatten, metanol och etanol, det löser sig inte i eter och kolväten, det är inte hygroskopiskt, är lagringsbart och har en behaglig aromatisk lukt.
Detta magnesiumsalt innehåller ca 5 mol hydratiseringsvatten. Det är inte hydroskopiskt, är stabilt och kan lagras under godtyckligt långa tider. Genom torkning under flera timmar vid 40 °C till 50 °C förlorar det en del av sitt kristallvatten (1 mol) och smälter sedan vid 118 °C till 120 °C. Vattenfri magnesium-4-hydroxibutyrat kan framställas genom att vatten avlägsnas genomsublimering och/eller indunstning av vatten under minskat partialtryck av vatten och vid förhöjd temperatur, eller genom kristallisation från en lösning som innehåller ett organiskt lösningsmedel. Det vattenfria saltet smälter vid 172-174 °C. Den kemiska analysen visar 10,50 vikt% magnesium (beräknat 10,55 vikt% magnesium). Alla modifieringar är icke hygroskopiska och stabila under lagring. 1 g av magnesiumsaltet löser sig i 2 ml vatten vid rumstemperatur, pH i vattenlösningen är 7. Det löser sig lätt i vatten, metanol och etanol, det löser sig inte i eter och kolväten, det är inte hygroskopiskt, är lagringsbart och har en behaglig aromatisk lukt.
Andra salter.
GHB:s litium- och ammoniumsalter skulle vara farliga att få i sig. Litiumjon är giftigt och tillsammans med NH3-lakton blir det pyrrolidon.
Syntes frågor och svar.
Q: Kan jag använda lut istället för ren natriumhydroxid?
A: Nej, det kan ha oförutsägbara resultat på din hälsa. Hårdvaruhandelns lut har inte någonstans nära de rigorösa renhetskriterierna för till exempel livsmedelskvalitet, ACS-kvalitet eller elektronikkvalitet. Vissa människor berättar om framgångsrika historier med lut, vilket verkligen är möjligt, men som sagt, resultaten är oförutsägbara.
Q: Jag har inte de glasvaror som du säger behövs, kan jag koka lösningen i en kastrull på spisen istället?
A: Nej, det kan du inte. Natriumhydroxiden kommer att korrodera metallen och diverse metalljoner kommer att hamna i din produkt. Du kan naturligtvis använda enklare glasvaror än i mina förslag och göra de nödvändiga justeringarna av proceduren.
Q: Jag kan inte omkristallisera Na-GHB från etanol. Det bildas en klibbig röra.
A: Din Na-GHB är inte torr, eller din etanol är inte vattenfri. Vatten gör omkristallisationen nästan omöjlig. Det faktum att natrium-GHB är deliquescent (hygroskopiskt) gör inte detta bättre. Du måste torka GHB noggrant, helst i en vakuumexsickator innan du försöker omkristallisera eller något annat improviserat alternativ. Den etanol du planerar att använda (oftast levererad med en renhet på 95%, resten är vatten) måste torkas genom torkning över vattenfritt kalciumsulfat följt av destillation från kalciumoxid med lämpliga åtgärder vidtagna för att utesluta fukt från reaktionen.
F: Var kan jag köpa butyrolakton / Är det säkert att köpa butyrolakton?
A: Jag har ingen aning om hur situationen är för dig i ditt land. Svaren på dessa frågor beror i hög grad på vem du är och var du bor. Du kan dock kontakta någon av de många säljare av GHB-kit som finns på nätet.
A: Nej, det kan ha oförutsägbara resultat på din hälsa. Hårdvaruhandelns lut har inte någonstans nära de rigorösa renhetskriterierna för till exempel livsmedelskvalitet, ACS-kvalitet eller elektronikkvalitet. Vissa människor berättar om framgångsrika historier med lut, vilket verkligen är möjligt, men som sagt, resultaten är oförutsägbara.
Q: Jag har inte de glasvaror som du säger behövs, kan jag koka lösningen i en kastrull på spisen istället?
A: Nej, det kan du inte. Natriumhydroxiden kommer att korrodera metallen och diverse metalljoner kommer att hamna i din produkt. Du kan naturligtvis använda enklare glasvaror än i mina förslag och göra de nödvändiga justeringarna av proceduren.
Q: Jag kan inte omkristallisera Na-GHB från etanol. Det bildas en klibbig röra.
A: Din Na-GHB är inte torr, eller din etanol är inte vattenfri. Vatten gör omkristallisationen nästan omöjlig. Det faktum att natrium-GHB är deliquescent (hygroskopiskt) gör inte detta bättre. Du måste torka GHB noggrant, helst i en vakuumexsickator innan du försöker omkristallisera eller något annat improviserat alternativ. Den etanol du planerar att använda (oftast levererad med en renhet på 95%, resten är vatten) måste torkas genom torkning över vattenfritt kalciumsulfat följt av destillation från kalciumoxid med lämpliga åtgärder vidtagna för att utesluta fukt från reaktionen.
F: Var kan jag köpa butyrolakton / Är det säkert att köpa butyrolakton?
A: Jag har ingen aning om hur situationen är för dig i ditt land. Svaren på dessa frågor beror i hög grad på vem du är och var du bor. Du kan dock kontakta någon av de många säljare av GHB-kit som finns på nätet.
Prekursorer.
Den uppenbara prekursorn för syntesen av GHB är gamma-butyrolakton. Den kan tillverkas av prekursorer som t.ex. tetrahydrofuran (THF) med oxidationsmedel som ruteniumtetroxid, kalciumhypoklorit och salpetersyra. 4-Halosmörsyraderivat (klor, brom, jod) kan också användas. Som i syntesen nedan kan de omvandlas till gamma-butyrolakton genom destillation med natriummetoxid.
gamma-butyrolakton från 4-bromsmörsyra.
Till en lösning av 7,8 g natrium i 500 ml absolut alkohol tillsattes 60,5 g 4-bromsmörsyra. Reaktionsblandningen kokades under en återloppskylare i cirka fem timmar. Under denna tid separerades natriumbromid. Alkoholen destillerades från ett ångbad och laktonen separerades från natriumbromiden genom extraktion med eter. Etern indunstades och laktonen destillerades under vanligt tryck. Utbytet var 21,2 gram (67 %) av en produkt som kokade vid 202-206 °C. Ett alternativ kan vara fri radikal klorering av smörsyra med svavelklorid i närvaro av peroxider, och separera isomererna genom destillation, göra natriumsaltet av 4-klorsmörsyra och cyklisera till laktonen som med 4-bromerivatet ovan. gamma-butyrolakton kan också framställas av 4-metoxismörsyra, 3-fenoxipropylcyanid, gamma-dietylaminosmörsyra och beta-klor-etylvinyleter samt många andra lite för exotiska kemikalier. Industriellt tillverkas det vanligen genom att acetylen reagerar med formaldehyd under höga temperaturer och tryck.
Dehydrogenering av 1,4-butandiol (BDO) till gamma-butyrolakton (GBL).
En blandning av 90,1 g (1 mol) 1,4-butandiol, 4 g kopparkromitkatalysator och 0,15 g pulveriserad natriumhydroxid av reagenskvalitet (eller bättre KOH) rördes kraftigt och värmdes under återflöde. Vid cirka 200 °C skedde en livlig utveckling av väte, och temperaturen sjönk cirka 10 °C och dehydrogeneringen fortskred smidigt. Gasutvecklingen (39 L/2 mol per mol reagerad 1,4-butandiol) upphörde efter ca 3 h. Reaktionsblandningen kyldes till rumstemperatur, filtrerades från katalysatorn och destillerades under reducerat tryck för att ge gamma-butyrolakton i ca 80 % utbyte och oreagerad 1,4-butandiol i ca 10 % utbyte.
Framställning av enhögaktiv dehydrogeneringskatalysator av kopparkromit.
En lösning av 260 g koppar(II)nitrattrihydrat i 900 ml kranvatten vid 80 °C tillsattes under omrörning till en lösning av 178 g natriumdikromatdihydrat och 225 ml 28 % NH4OH som späddes upp till 900 ml vid 25 °C. Utfällningen samlades upp genom sugfiltrering och slammades upp i vatten tre gånger. Kopparammoniumkromatet torkades vid 75-80 °C över natten. Det pulveriserades och tillsattes i små portioner till en 1-liters kolv med tre halsar, utrustad med en rostfri omrörare av Hershberg-typ som skrapade nära kolvens botten. Kolven var delvis nedsänkt i ett oljebad vid 350 °C (med 300-320 °C kan man få goda resultat). Tillsatstiden var 15 minuter (mycket ångor utvecklades) och blandningen omrördes vid 350 °C i ytterligare 15 minuter efter att allt var klart. Detkylda och svarta dammiga pulvret användes som det är för dehydrogeneringen.
En lösning av 260 g koppar(II)nitrattrihydrat i 900 ml kranvatten vid 80 °C tillsattes under omrörning till en lösning av 178 g natriumdikromatdihydrat och 225 ml 28 % NH4OH som späddes upp till 900 ml vid 25 °C. Utfällningen samlades upp genom sugfiltrering och slammades upp i vatten tre gånger. Kopparammoniumkromatet torkades vid 75-80 °C över natten. Det pulveriserades och tillsattes i små portioner till en 1-liters kolv med tre halsar, utrustad med en rostfri omrörare av Hershberg-typ som skrapade nära kolvens botten. Kolven var delvis nedsänkt i ett oljebad vid 350 °C (med 300-320 °C kan man få goda resultat). Tillsatstiden var 15 minuter (mycket ångor utvecklades) och blandningen omrördes vid 350 °C i ytterligare 15 minuter efter att allt var klart. Detkylda och svarta dammiga pulvret användes som det är för dehydrogeneringen.
Syntes av gamma-butyrolakton från tetrahydrofuran (THF).
Till en omrörd blandning av 7,2 g (0,1 mol) tetrahydrofuran i 100 ml vatten tillsattes 15,1 g natriumbromat och 13,6 g (0,1 mol) kaliumvätesulfat. Extern kylning var nödvändig för att hålla lösningens temperatur mellan 25-30 °C. Omrörningen fortsatte i 16 timmar vid rumstemperaturm , varefter all THF hade förbrukats. För att släcka eventuellt överskott av bildad brom användes sur natriumsulfitlösning [bisulfit bör fungera lika bra]. Således tillsattes 140-150 ml av en 10% lösning och 13,6 g (0,1 mol) kaliumvätesulfat. Reaktionen kyldes och extraherades med 5x30 ml diklormetan. De kombinerade organiska skikten torkades över MgSO4 och lösningsmedlet avlägsnades under vakuum. Återstoden destillerades för att ge gamma-butyrolakton i 73% utbyte (bp 204-205 ° C).
Sandmeyer-reaktion av GABA till GBL/GHB.
Det är fantastiskt för en kemist som vill framställa GHB i små mängder och med höga utbyten och göra det utan att direkt skaffa några reglerade kemikalier som gamma-butyrolakton (GBL) eller 1,4-butandiol (BDO). Den undviker också de typiskt låga utbyten som ses vid oxidation av tetrahydrofuran (THF). Den använder en lättåtkomlig aminosyra, gamma-aminosmörsyra (GABA), och natriumnitrit (NaNO2). Den skalar mycket snyggt och körs utan alltför mycket krångel. Inte en enda misstänkt kemikalie används.
Sandmeyer-reaktionen använder salpetersyra för att omvandla aminer till diazoniumsalter. Denna reaktion, som den gäller för att förvandla GABA till GHB, visas i den första reaktionen nedan. Alifatiska diazoniumsalter genomgår snabbt hydrolys i närvaro av vatten, varvid kvävgas avges och en hydroxylgrupp lämnas kvar. Detta visas i det andra steget. Som ett resultat av dessa reaktioner kan GABA omvandlas till GHB i en enkel enpottsreaktion.
Kör reaktionen.
Ställ upp en 2 L-kolv i isvatten ovanpå en magnetomrörare. Nu.
Kör reaktionen.
Ställ upp en 2 L-kolv i isvatten ovanpå en magnetomrörare. Nu.
- Tillsätt3 mol GABA (309,4 g).
- Tillsätt3 mol NaNO2 (207,0 g).
- Tillsätt700 ml vatten (total volym blir ca 1100 ml).
- Sätt ien 1" omrörningsstav och börja omrörningen.
- Fyll en500 ml tryckutjämnad additionstratt med 3,3 mol HCl(aq) (385,0 g 31,25%, 334,8 ml 31,25%).
- Förse additionstratten med engasutloppsadapter och ventilera utåt.
Börja långsamt droppa ner saltsyran i blandningen. Droppa i en konstant hastighet av ca 1 droppe var 2-5:e sekund. Öka hastigheten allteftersom tiden går och byt ut isen vid behov, men låt inte utvecklingen av den bruna giftiga gasen bli kraftig. Efter cirka en timme efter att den sista droppen syra har tillsatts behöver isen inte längre bytas ut. När reaktionen är klar, fortsätt att extrahera. (vanligtvis 24-36 timmar senare)
Extraktion.
Det finns många alternativ för detta. Detta är fortfarande ett pågående arbete, men efter cirka 20 körningar kom jag att använda detta arbete. Du kan använda etylacetat (EtOAc), kloroform eller metylenklorid (diklormetan aka DCM) för att utföra lösningsmedelsextraktionerna. Jag har normalt använt DCM eftersom det är trevligt eftersom det organiska skiktet sjunker till botten av separeringstratten.
1. Uppställningför en enkel destillation
Extraktion.
Det finns många alternativ för detta. Detta är fortfarande ett pågående arbete, men efter cirka 20 körningar kom jag att använda detta arbete. Du kan använda etylacetat (EtOAc), kloroform eller metylenklorid (diklormetan aka DCM) för att utföra lösningsmedelsextraktionerna. Jag har normalt använt DCM eftersom det är trevligt eftersom det organiska skiktet sjunker till botten av separeringstratten.
1. Uppställningför en enkel destillation
a) Destillera och kasta ut de första 5-10 ml destillat eftersom det innehåller en hel del kväveoxider. Destillerabort så mycket vatten som möjligt, i princip tills natriumkloriden börjar mätta vattenskiktet och fällas ut.
b) Återstoden av destillatet (ca 700 ml) kommer att innehålla ca 1 g GBL/10 ml.
c) Behandla återstoden av destillatet med NaHCO3 vid återflöde i 30 minuter.
d) Koka med ca 5 % volym aktivt kol (dvs. 0,35 ml aktivt kol) (jämfört med lösningens volym) i 5-10 minuter.
e) Låt svalna och filtrera, tvätta kolet med destillerat vatten. SparaNaGHB.
2. Extrahera resten av vattenlösningen 5 gånger med 625 ml DCM.
3. Destillera bort DCM (återanvänd DCM!).
4 . Destillera GBL (under vakuum om det finns tillgängligt).
5 . Reagera med NaHCO3 och destillerat vatten och behandla med aktivt kol som tidigare.
Vanligtvis tillverkas 375 g NaGHB från den lösningsmedelsextraherade GBL, varav 100 g NaGHB från det vattenhaltiga destillatet. Även om omvandlingen är nästan kvantitativ (mätt med GC/MS), är det totala återvunna utbytet vanligtvis ca 70%.
3. Destillera bort DCM (återanvänd DCM!).
4 . Destillera GBL (under vakuum om det finns tillgängligt).
5 . Reagera med NaHCO3 och destillerat vatten och behandla med aktivt kol som tidigare.
Vanligtvis tillverkas 375 g NaGHB från den lösningsmedelsextraherade GBL, varav 100 g NaGHB från det vattenhaltiga destillatet. Även om omvandlingen är nästan kvantitativ (mätt med GC/MS), är det totala återvunna utbytet vanligtvis ca 70%.
Last edited:
