- Joined
- Jun 24, 2021
- Messages
- 1,718
- Solutions
- 2
- Reaction score
- 1,966
- Points
- 113
- Deals
- 666
Informations générales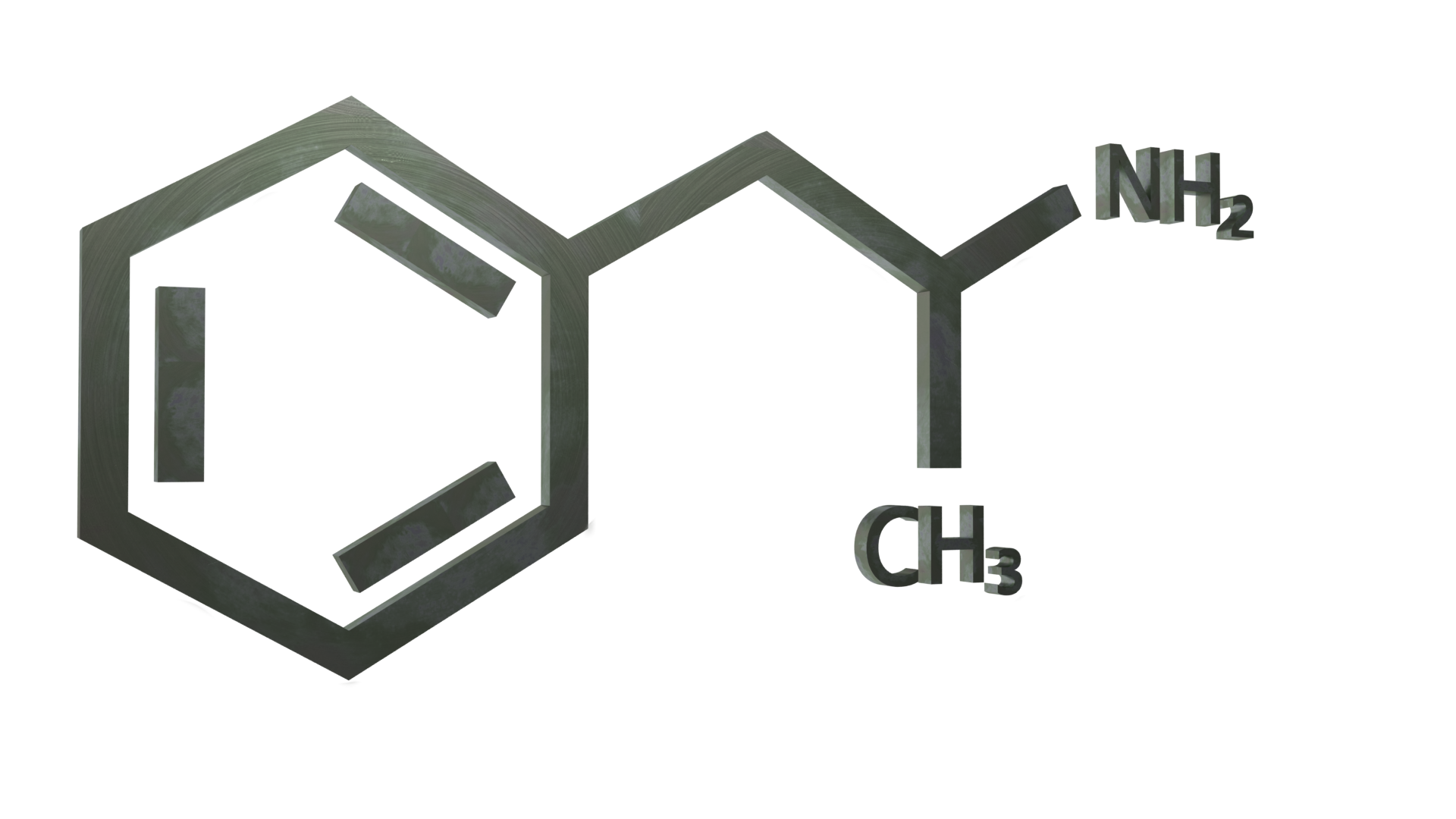
L'amphétamine (également connue sous le nom d'alpha-méthylphénéthylamine, d'amfétamine et de speed) est une substance stimulante classique de la classe des phénéthylamines. C'est le composé parent des amphétamines substituées, un groupe diversifié qui comprend la méthamphétamine, la MDMA, la cathinone et le bupropion. Le mécanisme d'action consiste à favoriser la libération des neurotransmetteurs dopamine et norépinéphrine.
L'amphétamine, une substance découverte il y a plus de 100 ans, est l'une des drogues contrôlées les plus restreintes. Auparavant, elle était utilisée pour une grande variété d'affections et cela a changé jusqu'à ce que son utilisation soit fortement restreinte. L'amphétamine, dont la formule chimique est l'alpha-méthylphénéthylamine, a été découverte en 1910 et synthétisée pour la première fois en 1927. Après avoir prouvé qu'elle réduisait l'anesthésie induite par la drogue et produisait de l'excitation et de l'insomnie, le mélange racémique d'amphétamine a été enregistré par Smith, Kline et French en 1935. La structure de l'amphétamine présente un centre chiral et existe sous forme d'isomères dextro et lévogyre. Le premier produit de Smith, Kline et French a été approuvé par la FDA en 1976.
Dans les années 1930, il était vendu sans ordonnance sous le nom de "Benzedrine" en tant que décongestionnant. Elle a ensuite été largement utilisée pour traiter une série d'affections telles que la gueule de bois, la narcolepsie, la dépression et l'obésité. Pendant la Seconde Guerre mondiale, l'amphétamine a été utilisée pour favoriser l'éveil des soldats. Cette utilisation a entraîné une importante surproduction d'amphétamine et tous les excédents après la fin de la guerre se sont retrouvés sur le marché noir, ce qui a entraîné le début de l'abus. En raison des problèmes de dépendance et d'abus, l'amphétamine a finalement été inscrite sur la liste des substances contrôlées de la "Convention sur les substances psychotropes" des Nations unies de 1971.
Aujourd'hui, l'amphétamine est principalement un médicament de prescription utilisé pour traiter le trouble déficitaire de l'attention avec hyperactivité (TDAH), la narcolepsie et l'obésité. En outre, elle fait l'objet d'un usage illicite très répandu en tant qu'agent d'amélioration des performances et substance récréative.
Propriétés physiques
- Formule C9H13N
- Masse molaire 135,210 g/mol
- Densité 0,936 g/cm3 à 25 °C
- Point de fusion 11,3 °C (52,3 °F)
- Point d'ébullition 200-203 °C (397 °F) à 760 mmHg
Propriétés chimiques
La base libre de l'amphétamine est un liquide huileux volatil incolore avec une odeur caractéristique de "poisson" et un goût âcre et brûlant, peu soluble dans l'eau, facilement soluble dans les solvants organiques, point d'ébullition 200-203 °C.
L'amphétamine est un homologue méthylique du neurotransmetteur des mammifères, la phénéthylamine, dont la formule chimique est C9H13N. L'atome de carbone adjacent à l'amine primaire est un centre stéréogène, et l'amphétamine est composée d'un mélange racémique 1:1 de deux énantiomères. Ce mélange racémique peut être séparé en ses isomères optiques : la lévoamphétamine et la dextroamphétamine (isomères l et d). Les sels solides de l'amphétamine fréquemment préparés comprennent le chlorhydrate, le phosphate et le sulfate d'amphétamine. Le sulfate de dextroamphétamine est le sel énantiopur le plus courant. L'amphétamine est également le composé parent de sa propre classe structurelle, qui comprend un certain nombre de dérivés psychoactifs.
Méthodes de synthèse
Il existe une liste des méthodes de synthèse de l'amphétamine les plus courantes. Chacune d'entre elles présente ses propres avantages et inconvénients. La synthèse non sélective la plus répandue est la réduction P2NP, qui peut être réalisée avec un amalgame d' aluminium(Al). Il est également possible de réduire le P2NP à l'aide de NaBH4, de LAH ou d'hydrogène gazeux avec un catalyseur (PtO2 ou Pd/C) et une pression excessive. Le P2NP peut être synthétisé par simple condensation du nitroéthane avec le benzaldéhyde.
L'une des méthodes les plus courantes de production clandestine d'amphétamine est la réaction de Leuckart, qui consiste en la condensation de phénylacétone (phényl-2-propanone, P2P) avec du formamide ou du formiate d'ammonium en présence d'acide formique, suivie d'une hydrolyse acide de la N-formylamphétamine résultante.
La mphétamine peut également être préparée par amination réductrice de la phénylacétone (P2P ) en présence d'un catalyseur métallique. La réaction se déroule avec la formation d'une imine intermédiaire. Voici des exemples de réaction : Réduction catalytique hétérogène de la phénylacétone avec de l'ammoniac. Le catalyseur peut être du palladium sur carbone, de l'oxyde de platine ou du nickel de Raney. Restauration avec des amalgames d'aluminium, de zinc ou de magnésium.
Si nécessaire, les stéréoisomères amphétaminiques dextroamphétamine et lévoamphétamine peuvent être séparés à l'aide d'acide tartrique. En outre, une méthode a été publiée pour la synthèse stéréosélective de la dextroamphétamine, qui consiste en l'amination réductrice de la phénylacétone avec la S-α-méthylbenzylamine. L'imine obtenue est réduite avec du Pd/C ou du nickel de Raney et recristallisée sous forme de chlorhydrate. Le groupe N-benzyle est ensuite hydrogénolysé en présence de palladium sur charbon pour former de la dextroamphétamine de grande pureté optique.
Analyse et purification
Des substances toxiques et dangereuses sont utilisées dans toutes les méthodes de synthèse de l'amphétamine. Il existe deux méthodes de purification de l'amphétamine : le lavage du produit et l'extraction acide-base.
Le lavage de la drogue est une étape essentielle et finale de presque toutes les synthèses. Il est parfois répété plusieurs fois. La méthode est accessible à tous, ne nécessite pas de compétences, peut améliorer de manière significative la qualité du produit et de la présentation. La méthode est idéale pour les petites quantités. Le lavage est indiqué pour les résidus de P2NP, d'alcalis, d'acides, etc. Le lavage n'élimine pas les contaminants (acétaminophène, caféine, etc.) et les sels de mercure.
La méthode la plus accessible, et donc la plus facile, consiste à laver l'amphétamine avec de l'alcool isopropylique (IPA). L'acétone anhydre est plus difficile à utiliser. L'IPA ne contient pas d'eau et ne dissout donc pas les sels d'amphétamine. La clé du succès du processus est l'absence d'eau. Elle est nécessaire pour éviter que les amph ne se dissolvent dans les polluants, car ils seront rejetés.
L' extraction acide-base (ABE), en tant que méthode de purification, permet d'obtenir un médicament de haute qualité. La méthode est bonne parce qu'elle utilise les réactifs, les outils et les instruments disponibles.
L'amphétamine est souvent coupée de manière inacceptable par la caféine, l'amidon, les nootropiques tels que la cinnarizine et le piracétam, l'a-PVP, la méthamphétamine et d'autres stimulants et substances pharmaceutiques. Il existe plusieurs méthodes pour vérifier votre taux d'amphétamine. La méthode la plus populaire et la plus simple est celle des réactifs de dépistage des drogues. D'autres méthodes sont décrites dans le protocole d'évaluation des amphétamines.
Voici des photos de différents échantillons d'amphétamine après des tests avec des réactifs.
Effets et dosage
Les effets subjectifs comprennent la stimulation, l'amélioration de la concentration, l'augmentation de la motivation, l'augmentation de la libido, la suppression de l'appétit et l'euphorie. L'amphétamine est généralement prise par voie orale, mais elle peut également être insufflée, injectée ou administrée par voie rectale. Des doses plus faibles ont tendance à augmenter la concentration et la productivité, tandis que des doses plus élevées ont tendance à augmenter la sociabilité, le désir sexuel et l'euphorie.
L'amphétamine présente un fort potentiel d'abus. L'usage chronique (c.-à-d. dose élevée, administration répétée) est associé à un redosage compulsif, à une tolérance croissante et à une dépendance psychologique. En outre, l'abus a été associé à un certain nombre de problèmes de santé, en particulier des problèmes cardiovasculaires tels que l'hypertension artérielle et un risque accru d'accident vasculaire cérébral. Il est fortement conseillé d'utiliser des pratiques de réduction des risques si l'on consomme cette substance.
[SPOILER=Effets physiques]
Stimulation - L'amphétamine est considérée comme très énergique et stimulante. Elle peut encourager les activités physiques telles que la danse, la socialisation, la course ou le nettoyage. Le style particulier de stimulation que produit l'amphétamine peut être décrit comme forcé. Cela signifie qu'à des doses élevées, il devient difficile, voire impossible, de rester immobile. Les mâchoires se serrent, des secousses corporelles involontaires et des vibrations se produisent, entraînant des tremblements extrêmes de tout le corps, une instabilité des mains et une perte générale du contrôle de la motricité fine. Ces symptômes sont remplacés par une légère fatigue et un épuisement général pendant la durée de l'expérience.
-
Sensations corporelles spontanées - Le "body high" de l'amphétamine peut être décrit comme une sensation modérée de picotement euphorique qui englobe tout le corps. Cette sensation est présente de manière constante, augmente régulièrement avec le début de l'expérience et atteint sa limite une fois le pic atteint.
-
Euphorie physique
-
Rythme cardiaque anormal
-
Augmentation du rythme cardiaque
-
Augmentation de la pression artérielle - d'environ 30 mmHg systolique et 20 mmHg diastolique, chez des utilisateurs naïfs prenant 40 mg de d-AMP.
-
Suppression de l'appétit
-
Bronchodilatation
-
Déshydratation
-
Sécheresse buccale
-
Miction fréquente
-
Difficulté à uriner
-
Augmentation de la température corporelle
-
Augmentation de la transpiration
-
Manie - L'amphétamine peut provoquer une manie chez les personnes génétiquement prédisposées, comme celles qui souffrent de troubles bipolaires ou de schizophrénie. Des doses plus élevées et la privation de sommeil semblent augmenter le risque.
-
Nausées - Cet effet peut être atténué en mangeant avant la prise et tout au long de l'expérience.
-
Dilatation de la pupille - Cet effet n'est ressenti qu'à des doses communes ou élevées et est plus important lors de la descente.
-
Syncope réflexe
-
Amélioration de l'endurance
-
Grincement des dents - Le grincement des dents peut être présent à des doses élevées. Cependant, il est moins intense que celui de la MDMA.
-
Dysfonction érectile temporaire
-
Vasoconstriction - La consommation d'amphétamines entraîne une constriction des vaisseaux sanguins, ce qui fait que certaines parties du corps ne sont pas suffisamment irriguées. Cela peut provoquer des sensations de picotement ou de douleur, une sensation de froid, un engourdissement, une pâleur ou des changements de couleur de la peau, en particulier au niveau des doigts et des orteils.
[/SPOILER]
[SPOILER=Effet visuel]
-
Les effets visuels de l'amphétamine sont irréguliers et ne sont que légèrement perceptibles à des doses élevées. Ils sont quelque peu comparables aux effets visuels du délire et se produisent plus facilement dans les zones sombres.
[/SPOILER]
[SPOILER=Distortions]
-
Dérive - Cet effet est généralement subtil et à peine perceptible et ne se produit qu'à des doses plus élevées ou lorsqu'il est combiné avec du cannabis. Il s'agit généralement d'une dérive de niveau 1 à 2.
- Altération de la luminosité - L'amphétamine peut donner l'impression que les espaces sont plus lumineux en raison de ses effets de dilatation de la pupille.
- Traceurs - Cet effet est imperceptible à faible dose. Il est plus prononcé avec des doses plus importantes et surtout lorsque la personne est privée de sommeil, ce qui peut être facilement provoqué par d'autres effets de cette substance. Transformations - Cet effet se produit très rarement, et typiquement seulement lorsque l'utilisateur a pris de fortes doses, qu'il est en train de redescendre, ou qu'il est resté éveillé pendant des périodes inhabituellement longues. Lorsqu'elles se produisent, elles sont généralement très légères.
[/SPOILER]
[SPOILER=États hallucinatoires]
-
Transformations - Cet effet se produit très rarement, et généralement seulement lorsque l'utilisateur a pris de fortes doses, qu'il est en train de redescendre, ou qu'il est resté éveillé pendant des périodes inhabituellement longues. Les effets sont généralement très légers lorsqu'ils se produisent.
-
Géométrie - Cet effet est signalé par certains consommateurs d'amphétamine et de substances apparentées, généralement à des doses élevées, lorsqu'ils tentent de dormir. Il peut être décrit dans ses variantes comme simpliste, algorithmique, synthétique, faiblement éclairé, multicolore, brillant, à bords nets, zoomé, lisse, angulaire, immersif et progressif. Il se produit généralement au niveau 3, mais peut évoluer vers les niveaux 4 et 5 lorsqu'il est associé à des substances telles que le cannabis ou le DXM.
[/SPOILER]
[SPOILER=Effets cognitifs]
- Amélioration de l'analyse
- Euphorie cognitive
- Redosage compulsif
- Gonflement de l'ego
- Suppression des émotions - Cet effet est généralement plus intense à des doses légères et courantes, et est plus souvent rapporté dans le cadre d'un usage médical que récréatif.
- Amélioration de la concentration - Cet effet est plus efficace à des doses faibles ou modérées, car toute dose supérieure nuit généralement à la concentration.
- Augmentation de la libido - Bien que l'utilisation d'amphétamines puisse provoquer un sentiment d'amélioration sexuelle, la constriction des vaisseaux sanguins peut rendre difficile l'obtention ou le maintien d'une érection.
- Appréciation accrue de la musique
- Irritabilité - Ce phénomène est plus susceptible de se produire à des doses élevées.
- Amélioration de la mémoire
- Amélioration de la motivation
- Psychose - Cet effet ne se produit que chez les personnes prédisposées, ou après une utilisation chronique et fréquente, ou en raison d'un manque de sommeil.
- Suppression de la suggestibilité
- Accélération de la pensée
- Organisation de la pensée
- Distorsion du temps - Cet effet peut être décrit comme l'expérience d'un temps qui s'accélère et qui passe beaucoup plus vite qu'il ne le ferait normalement en état de sobriété.
- L'état d'éveil
[/SPOILER]
[SPOILER=After effects]
Les effets qui se produisent pendant la période de récupération d'un stimulant sont généralement négatifs et inconfortables par rapport aux effets qui se sont produits pendant la période de pointe. C'est ce qu'on appelle souvent le "comedown", qui se produit en raison de l'épuisement des neurotransmetteurs. Ses effets sont généralement les suivants
- Anxiété - L'anxiété peut atteindre des niveaux élevés pendant la descente chez certains utilisateurs.
- Suppression de l'appétit
- Fatigue cognitive
- la dépression
- Augmentation du rythme cardiaque - Alors que la concentration sanguine d'amphétamine et la plupart des effets subjectifs sont les plus élevés environ 3 heures après l'administration, le rythme cardiaque atteint son maximum beaucoup plus tard, 10 heures après l'administration.
- Irritabilité
- Suppression de la motivation
- Jambes agitées
- Paralysie du sommeil - Certains utilisateurs constatent une paralysie du sommeil après avoir consommé de l'amphétamine.
- Suppression des rêves
- Ralentissement de la pensée
- Réveil - L'insomnie consécutive à une série répétée de doses d'amphétamine peut durer plus d'une journée chez certains utilisateurs.
- Suppression de la motivation - Les expériences peuvent aller d'une légère démotivation à des états extrêmes de désintérêt. Cet effet est plus important à des doses courantes et importantes.
[/SPOILER]
Pharmacologie
L'amphétamine exerce ses effets sur le comportement en augmentant l'activité de signalisation des neurotransmetteurs norépinéphrine et dopamine dans les voies de la récompense et de la fonction exécutive du cerveau. Les effets de renforcement et de motivation de l'amphétamine sont principalement dus à l'augmentation de l'activité dopaminergique dans la voie mésolimbique.
Les effets euphorisants et stimulants de la locomotion de l'amphétamine dépendent de l'ampleur et de la rapidité avec lesquelles elle augmente les concentrations synaptiques de dopamine et de noradrénaline dans le striatum.
L'amphétamine est un puissant agoniste complet du récepteur 1 associé aux amines traces (TAAR1) et interagit avec le transporteur vésiculaire de monoamines 2 (VMAT2). L'action combinée sur le TAAR1 et le VMAT2 entraîne une augmentation des concentrations de dopamine et de norépinéphrine dans les synapses, ce qui stimule l'activité neuronale.
La dextroamphétamine est un agoniste plus puissant du TAAR1 que la lévoamphétamine. Par conséquent, la dextroamphétamine produit une plus grande stimulation du SNC que la lévoamphétamine, environ trois à quatre fois plus, mais la lévoamphétamine a des effets cardiovasculaires et périphériques légèrement plus importants.
La biodisponibilité exacte de l'amphétamine n'est pas connue, mais on estime qu'elle est supérieure à 75 % par voie orale et plus élevée par injection ou administration intranasale. Son absorption et son excrétion peuvent dépendre du pH. Comme il s'agit d'une base faible, plus l'environnement est basique, plus le médicament se trouve sous une forme liposoluble et l'absorption à travers les membranes cellulaires riches en lipides est fortement favorisée. La réponse maximale de l'amphétamine se produit 1 à 3 heures après l'administration orale et environ 15 minutes après l'injection. L'absorption complète de l'amphétamine se fait généralement au bout de 4 à 6 heures. La forme basique est plus facilement absorbée dans l'intestin et moins facilement éliminée par les reins, ce qui peut augmenter sa demi-vie. Elle est éliminée par les reins par excrétion et une petite quantité est éliminée par les enzymes hépatiques.
Données sur le marché illégal
Offre mondiale de stimulants de type amphétamine (ATS)
Une quantité record de plus de 525 tonnes de STA a été saisie en 2020, ce qui représente une augmentation de 15 % par rapport à l'année 1 et poursuit la tendance à la hausse observée sur la période 2010-2020. Les quantitésdeméthamphétamine saisies ont été multipliées par cinq au cours de cette période de dix ans, les quantités d'amphétamine saisies ont presque quadruplé etlesquantités d'"ecstasy" saisies ont plus que triplé.
La consommation d'amphétamines a continué d'augmenter, mais des signes indiquent une diminution de la demande de traitement en 2020. Sur la base principalement des réponses autodéclarées aux enquêtes en population générale, on estime que 34 millions de personnes âgées de 15 à 64 ans, soit 0,7 % de la population mondiale, ont consommé des amphétamines au cours de l'année écoulée, et que 20 millions (0,4 %) ont consommé des substances de type "ecstasy". Certains de ces usagers ont consommé les deux types de substances. Les deux amphétamines les plus couramment utilisées sont l'amphétamine et la méthamphétamine.
L'estimation mondiale de la consommation d'amphétamines était similaire en 2010, avec 33 millions de consommateurs au cours de l'année écoulée, soit 0,7 % de la population âgée de 15 à 64 ans. Toutefois, ces estimations doivent être interprétées avec prudence en raison du manque de données provenant des principaux pays consommateurs d'Asie, où d'autres indicateurs du marché, tels que les saisies et les prix, suggèrent une expansion au cours de la dernière décennie. Les informations qualitatives basées sur les perceptions des tendances rapportées par les experts nationaux à l'ONUDC montrent une augmentation continue de la consommation d'amphétamines et du nombre de personnes en traitement pour des amphétamines au cours de la dernière décennie. Toutefois, les données pour 2020 montrent que cette tendance à la hausse s'est interrompue et que le nombre de personnes en traitement pour des amphétamines pourrait avoir diminué, ce qui correspond à une baisse générale des traitements à la suite de la pandémie de COVID-19. e Les tendances dérivées de ces informations qualitatives sont cohérentes avec les indicateurs d'offre disponibles, tels que les prix et les saisies, qui indiquent une expansion continue du marché des amphétamines à l'échelle mondiale. Les informations qualitatives de ce type souffrent de limites méthodologiques, mais elles ont l'avantage de prendre en compte des études à petite échelle et des observations d'experts concernant des pays où les enquêtes sur la consommation de drogues ne sont pas menées régulièrement. Les informations qualitatives sur les tendances de la consommation d'"ecstasy" ont été communiquées sous différentes catégories par les pays avant la mise en œuvre par l'ONUDC de son nouvel outil de collecte de données (le questionnaire actualisé pour les rapports annuels, qui est entré en vigueur en 2020), de sorte que les rapports qualitatifs sur les tendances de la consommation d'"ecstasy" sont limités à la période 2019-2020. Ces rapports suggèrent une augmentation modérée au niveau mondial. Parallèlement, des études menées dans des pays où l'ecstasy est utilisée à des fins récréatives suggèrent que la consommation d'ecstasy a diminué plus que celle de toute autre drogue pendant la pandémie dans ces pays. L'analyse des eaux usées, bien que limitée géographiquement à l'Europe, à l'Amérique du Nord et à certaines parties de l'Asie et de l'Océanie, suggère également que la consommation d'"ecstasy" a diminué entre 2019 et 2020 plus que la consommation d'amphétamines. Dans la majorité des lieux analysés, des niveaux accrus de consommation de MDMA ont été identifiés, tandis que dans une légère majorité de ces lieux, une augmentation de la consommation d'amphétamines et une diminution de la consommation de méthamphétamine ont été détectées. Les premières données d'analyse des eaux usées de 2021 suggèrent une augmentation globale de la consommation d'amphétamines dans la majorité des lieux surveillés par le groupe Sewage Analysis CORe, dont la plupart se trouvent en Europe, entre 2020 et 2021 ; une augmentation et une diminution de la consommation de méthamphétamine dans à peu près le même nombre de lieux ; et une diminution continue de la consommation de MDMA dans une grande majorité de lieux.
