G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,660
- Solutions
- 3
- Reaction score
- 2,735
- Points
- 113
- Deals
- 1
Introduction.
Ce dossier traite de la synthèse du GHB et des composés apparentés. Il est extrêmement dangereux d'essayer de synthétiser le GHB sans avoir les connaissances nécessaires en chimie organique pratique. La manière la plus simple de produire du GHB est l'hydrolyse de la lactone correspondante (un ester cyclique intramoléculaire) en l'acide hydroxy désiré. L'hydrolyse de l'ester peut se faire de deux manières : Une réaction catalysée par un acide ou une réaction catalysée par une base. La réaction catalysée par unebase est notre choix ici car la réaction n'est pas réversible comme la réaction catalysée par un acide, et nous obtiendrons donc des rendements plus élevés, et nous obtiendrons le sel de sodium du GHB, car l'acide libre n'est pas stable, et se transformera immédiatement en gamma-butyrolactone à nouveau.
Transformation du gamma-butyrolactone en gamma-hydroxy-butyrate de sodium (Na-GHB).
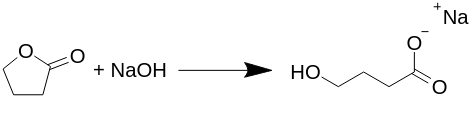
La réaction se déroule de manière équimolaire (le même nombre de chaque molécule réagit) et il n'y a pas de sous-produits produits lors de cette réaction, tels que de l'hydrogène, de l'eau ou quoi que ce soit d'autre, comme cela est proposé dans plusieurs autres textes. Toutes les préparations publiées de GHB, ou plus exactement de Na-GHB, font refluer le butyrolactone avec de l'hydroxyde de sodium dans divers solvants, généralement dans de l'alcool aqueux, mais cela n'est pas nécessaire.
Propriétés physiques/chimiques.
gamma-Butyrolactone.
Poids moléculaire 86,09 ; mp -43,53 °C ; bp 204°C ; d 1,12 g/ml
No CAS : [96-48-0]
Miscible à l'eau, soluble dans le méthanol, l'éthanol, l'acétone, l'éther, le benzène
LD50 : 1720 mg/kg (voie orale, souris) 1540 mg/kg (voie orale, rat)
Utilisations : Solvant, décapant, électrolyte de condensateur, en chimie organique
Synonymes : GBL, BLO, butyrolactone, gamma-hydroxy butyric acid lactone, 1,2-butanolide, 1,4-butanolide, 4-butanolide, 2-oxanolone, tétrahydro-2-furanone, dihydro-2(3H)-furanone.
GHB sodique.
Poids moléculaire 126,09 ; mp 145-146 °C
No CAS : [502-85-2]
DL50:2700 mg/kg (voie orale, rat)
Synonymes : Gamma-OH, oxybate de sodium, gamma-oxybutyrate de sodium, Somatomax PM, Wy-3478, NSC-84223, Somsanit, Anétamine.
GHB potassique.
Poids moléculaire : 142,20
GHB calcique.
Poids moléculaire 246,16 ; mp 164-166 °C, 166-168 °C.
GHB de magnésium.
Poids moléculaire 230,39 ; mp (anhydre) 172-174 °C ; tétrahydrate 118-120 °C ; pentahydrate 76-78 °C.
Poids moléculaire 86,09 ; mp -43,53 °C ; bp 204°C ; d 1,12 g/ml
No CAS : [96-48-0]
Miscible à l'eau, soluble dans le méthanol, l'éthanol, l'acétone, l'éther, le benzène
LD50 : 1720 mg/kg (voie orale, souris) 1540 mg/kg (voie orale, rat)
Utilisations : Solvant, décapant, électrolyte de condensateur, en chimie organique
Synonymes : GBL, BLO, butyrolactone, gamma-hydroxy butyric acid lactone, 1,2-butanolide, 1,4-butanolide, 4-butanolide, 2-oxanolone, tétrahydro-2-furanone, dihydro-2(3H)-furanone.
GHB sodique.
Poids moléculaire 126,09 ; mp 145-146 °C
No CAS : [502-85-2]
DL50:2700 mg/kg (voie orale, rat)
Synonymes : Gamma-OH, oxybate de sodium, gamma-oxybutyrate de sodium, Somatomax PM, Wy-3478, NSC-84223, Somsanit, Anétamine.
GHB potassique.
Poids moléculaire : 142,20
GHB calcique.
Poids moléculaire 246,16 ; mp 164-166 °C, 166-168 °C.
GHB de magnésium.
Poids moléculaire 230,39 ; mp (anhydre) 172-174 °C ; tétrahydrate 118-120 °C ; pentahydrate 76-78 °C.
Procédures de laboratoire pour la synthèse des sels de GHB.
Veuillez suivre les procédures de sécurité habituelles en laboratoire. Portez une blouse et des lunettes de protection. Vous travaillerez avec des solutions caustiques et des solvants chauds ! Soyez conscient des risques associés à la fabrication du GHB ! Ne travaillez jamais seul !
GHB sodique.
Procédure :
Dissoudre 130 grammes (3,25 moles) d'hydroxyde de sodium pur dans 400 ml d'eau distillée dans un ballon à fond rond à trois cols de 1000 ml tout en agitant. La dissolution est exothermique et la solution s'échauffe. Un bain d'eau froide peut être utilisé pour réguler la température. Lorsque tout a été dissous pour former une solution claire, ajouter lentement 250 ml (280 g, 3,25 moles) de gamma-butyrolactone par portions de 50 ml en agitant bien. L'utilisation d'un entonnoir à chute est recommandée. L'ajout de gamma-butyrolactone à la solution d'hydroxyde de sodium est également exothermique, et s'il est ajouté trop rapidement, la solution commencera à bouillir, ce qui n'est pas souhaitable. Suivez la température à l'aide d'un thermomètre immergé. L'ajout du gamma-butyrolactone prendra entre 20 et 30 minutes. Lorsque tout a été ajouté, laissez le mélange réagir pendant 10 minutes supplémentaires en le remuant de temps en temps.
Il est maintenant temps de vérifier si la réaction est terminée en contrôlant le pH à l'aide d'un papier pH universel. Nous visons un pH de 7-8. S'il est trop élevé (pH > 8), ajouter 10 ml de gamma-butyrolactone et laisser réagir pendant quelques minutes supplémentaires. Si le pH est trop bas (pH < 7), ajouter quelques ml de solution concentrée de NaOH aq. Continuer ainsi jusqu'à ce que le pH se situe dans les limites souhaitées.
La solution est parfaitement limpide et a un goût légèrement salé. Elle peut être légèrement colorée en jaune, mais pas beaucoup si l'on a utilisé de la butyrolactone suffisamment pure (la distillation de la lactone avant utilisation règle ce problème, p.c. 204 °C). Si un acide est utilisé pour neutraliser une solution trop basique (au lieu d'ajouter plus de lactone), des cristaux du sel de sodium de l'acide peuvent précipiter dans la solution, et le goût est gravement altéré. La solution finale sera d'environ 750 ml, 50% NaGHB. Lasolution peut être concentrée (en faisant bouillir l'excès d'eau) à ~600 ml sans qu'elle ne cristallise à température ambiante, mais si on la concentre jusqu'à ~500 ml, elle se solidifiera invariablement.
Il est maintenant temps de vérifier si la réaction est terminée en contrôlant le pH à l'aide d'un papier pH universel. Nous visons un pH de 7-8. S'il est trop élevé (pH > 8), ajouter 10 ml de gamma-butyrolactone et laisser réagir pendant quelques minutes supplémentaires. Si le pH est trop bas (pH < 7), ajouter quelques ml de solution concentrée de NaOH aq. Continuer ainsi jusqu'à ce que le pH se situe dans les limites souhaitées.
La solution est parfaitement limpide et a un goût légèrement salé. Elle peut être légèrement colorée en jaune, mais pas beaucoup si l'on a utilisé de la butyrolactone suffisamment pure (la distillation de la lactone avant utilisation règle ce problème, p.c. 204 °C). Si un acide est utilisé pour neutraliser une solution trop basique (au lieu d'ajouter plus de lactone), des cristaux du sel de sodium de l'acide peuvent précipiter dans la solution, et le goût est gravement altéré. La solution finale sera d'environ 750 ml, 50% NaGHB. Lasolution peut être concentrée (en faisant bouillir l'excès d'eau) à ~600 ml sans qu'elle ne cristallise à température ambiante, mais si on la concentre jusqu'à ~500 ml, elle se solidifiera invariablement.
Préparation du GHB sodique à l'aide de bicarbonate de sodium (bicarbonate de soude, NaHCO3).
Ajouter 273 g de NaHCO3 (3,25 moles) à 1 125 ml d'eau distillée dans un ballon à fond rond à trois cols. Portez lentement la solution à ébullition tout en agitant avec une tige de verre ou un objet similaire. Tout le bicarbonate de soude se dissout. Le dioxyde de carbone s'échappe de la solution au fur et à mesure de l'ébullition. Ils'agit du bicarbonate de sodium qui se décompose en une base légèrement forte, le carbonate de sodium.
Réduire le feu à une légère ébullition et ajouter lentement 250 ml de gamma-butyrolactone (280 g, 3,25 moles). L'addition n'est pas immédiatement exothermique, comme pour la synthèse de l'hydroxyde de sodium. Maintenir cette solution à une légère ébullition pendant 30 minutes. Vérifier le pH à l'aide d'un papier pH universel. Nous visons un pH d'environ 7, mais une valeur comprise entre 6 et 8 est parfaitement sûre. Si le pH est trop élevé, ajoutez une petite quantité de GBL et continuez à refluer.
La solution est parfaitement claire et doit être absolument incolore. Si elle n'est pas parfaitement incolore, c'est-à-dire si l'on a utilisé du butyrolactone légèrement impur et que la solution a pris une couleur jaune clair, ajouter environ 100 ml de charbon actif. Laisser bouillir pendant 10 minutes. Refroidir la solution, puis filtrer en lavant le charbon actif deux ou trois fois avec des portions de 50 ml d'eau froide. Cette synthèse permet d'obtenir 410 g de NaGHB. Cette solution peut être concentrée à environ 50 % de NaGHB avant qu'elle ne commence à cristalliser. Si vous souhaitez obtenir une poudre, chauffez jusqu'à ce que la température de la solution atteigne 150 °C, puis versez-la dans un plat en pyrex refroidi et laissez-la refroidir et se solidifier. Cette synthèse est parfaite lorsqu'il n'y a pas d'hydroxyde de sodium de qualité ACS, alimentaire ou électronique disponible.
La solution est parfaitement claire et doit être absolument incolore. Si elle n'est pas parfaitement incolore, c'est-à-dire si l'on a utilisé du butyrolactone légèrement impur et que la solution a pris une couleur jaune clair, ajouter environ 100 ml de charbon actif. Laisser bouillir pendant 10 minutes. Refroidir la solution, puis filtrer en lavant le charbon actif deux ou trois fois avec des portions de 50 ml d'eau froide. Cette synthèse permet d'obtenir 410 g de NaGHB. Cette solution peut être concentrée à environ 50 % de NaGHB avant qu'elle ne commence à cristalliser. Si vous souhaitez obtenir une poudre, chauffez jusqu'à ce que la température de la solution atteigne 150 °C, puis versez-la dans un plat en pyrex refroidi et laissez-la refroidir et se solidifier. Cette synthèse est parfaite lorsqu'il n'y a pas d'hydroxyde de sodium de qualité ACS, alimentaire ou électronique disponible.
GHB de potassium.
Utiliser la synthèse de l'éthanol décrite ci-dessus pour le GHB sodique, mais remplacer les 130 grammes de NaOH par 182 grammes de KOH (ce calcul est basé sur le fait que l'atome K est plus lourd et que la teneur en eau du KOH est plus élevée que celle du NaOH). L'utilisation de KOH permet aux utilisateurs de K-GHB d'obtenir le supplément de potassium qui, selon certains, est nécessaire à l'administration de GHB. Il ne faut pas oublier que le K-GHB (en poudre) est légèrement moins actif (en poids) que le Na-GHB, car l'ion K est plus lourd que son homologue Na. Lesdifférences entre le K-GHB et le Na-GHB sont que le sel K est plus soluble dans l'eau que le sel Na, et que le goût est plus proche du sel/réglisse que du sel/savon du Na-GHB.
GHB calcique.
74 g d'hydroxyde de calcium analytiquement pur sont suspendus dans 200 ml d'eau distillée. 160 ml de 4-butyrolactone sont ajoutés par portions (chaque portion étant d'environ 5 à 10 ml) et sous agitation à cette suspension à température ambiante. Après l'ajout de 20 ml, le mélange réactionnel se réchauffe jusqu'à environ 50 °C à 60 °C. L'ajout de 4-butyrolactone est contrôlé de manière à ce que la température reste comprise entre environ 50 °C et 60 °C, ce qui prend environ 1 heure. Pendant ce temps, l'hydroxyde de calcium s'est pratiquement dissous. Le matériau réactionnel est contaminé par un léger précipité jaune rouille. Il est dilué avec 300 ml de méthanol, laissé reposer pendant quatre heures, puis filtré à travers un filtre plié. Le filtrat clair est traité avec précaution avec 200 ml d'acétone de telle sorte qu'après chaque portion d'acétone provoquant un précipité, on laisse le temps au précipité de se redissoudre. On obtient une solution claire comme de l'eau, qui est placée en vue de la cristallisation. Après deux heures de repos, des cristaux incolores commencent à se déposer. Dans cet état, la cristallisation est accélérée par l'ajout continu d'acétone (100 ml au total). La durée de cristallisation est de 24 heures. Les cristaux sont aspirés et lavés d'abord avec 50 ml de méthanol, puis avec 60 ml d'acétone. Les cristaux sont séchés à des températures d'environ 60 °C à 80 °C dans une armoire de séchage. Rendement : 230 g. Point de fusion : 166-168 °C. (immédiatement). Le produit est le sel de calcium non hygroscopique et sans eau de l'acide 4-hydroxybutyrique. Il est dissoluble à volonté dans l'eau, la solution aqueuse ayant un pH de 7 à 7,5. Le sel peut être conservé aussi longtemps que souhaité et ne se modifie pas à l'air. Même lors du stockage, l'eau n'est pas attirée par l'air.
Le résidu cristallise en une masse de cristaux incolores, qui est ensuite séchée à des températures d'environ 60 °C à 80 °C. Rendement : environ 105 g. Point de fusion : 164-166 °C. Le produit est le calcium di-(4-hydroxybutyrique). Il est recristallisé en le dissolvant dans un peu de méthanol, puis en ajoutant de l'acétone jusqu'à ce qu'il se trouble, et en cristallisant à froid.
Au lieu du méthanol, l'éthanol et l'isopropanol peuvent être utilisés pour la recristallisation avec le même succès. Si l'on n'utilise pas d'alcools contenant de l'eau comme milieu de recristallisation ou comme additif à la recristallisation et à la purification, on n'obtient pas de sels de calcium stables et, en particulier, non hygroscopiques. La teneur en eau des alcools doit être d'environ 3 à 10 % en volume. Le produit final ainsi obtenu se dissout facilement dans l'eau, n'est pas hydroscopique et a une odeur aromatique agréable.
Le résidu cristallise en une masse de cristaux incolores, qui est ensuite séchée à des températures d'environ 60 °C à 80 °C. Rendement : environ 105 g. Point de fusion : 164-166 °C. Le produit est le calcium di-(4-hydroxybutyrique). Il est recristallisé en le dissolvant dans un peu de méthanol, puis en ajoutant de l'acétone jusqu'à ce qu'il se trouble, et en cristallisant à froid.
Au lieu du méthanol, l'éthanol et l'isopropanol peuvent être utilisés pour la recristallisation avec le même succès. Si l'on n'utilise pas d'alcools contenant de l'eau comme milieu de recristallisation ou comme additif à la recristallisation et à la purification, on n'obtient pas de sels de calcium stables et, en particulier, non hygroscopiques. La teneur en eau des alcools doit être d'environ 3 à 10 % en volume. Le produit final ainsi obtenu se dissout facilement dans l'eau, n'est pas hydroscopique et a une odeur aromatique agréable.
GHB de magnésium .
60 g d'hydroxyde de magnésium (qualité analytique) sont mis en suspension dans 200 ml d'eau du robinet sous agitation. Dans un courant et sous agitation, 160 ml de butyrolactone sont mélangés à cette suspension. Le mélange est ensuite chauffé au bain-marie pendant 6 heures sous agitation dans un ballon de 2 litres. L'hydroxyde de magnésium se dissout pratiquement complètement. Le ballon est laissé au repos pendant la nuit, tandis que les contaminants se déposent et que la solution est décantée sans effort du dépôt de contaminants. Le décantat clair comme de l'eau est d'abord agité avec 100 ml d'acétone pendant 10 minutes. Le liquide sirupeux incolore, devenu plus visqueux, est à nouveau mélangé avec 100 ml d'acétone comme décrit ci-dessus, l'acétone est à nouveau éliminée par décantation et le sirop incolore assez visqueux est laissé à lui-même à température ambiante pendant environ 2 à 4 heures. Il se solidifie en une masse cristalline incolore qui est broyée dans un mortier et séchée pendant plusieurs heures à l'air. Point de fusion : 76 °C à 78 °C. Rendement : 314 g sous forme analytiquement pure.
Ce sel de magnésium contient environ 5 moles d'eau d'hydratation. Il n'est pas hydroscopique, est stable et peut être stocké pendant des périodes arbitrairement longues. En séchant pendant plusieurs heures entre 40 °C et 50 °C, il perd une partie de son eau de cristallisation (1 mole) et fond alors à 118 °C ou 120 °C. Le 4-hydroxybutyrate de magnésium exempt d'eau peut être produit par élimination de l'eau par sublimation et/ou évaporation de l'eau sous une pression partielle d'eau réduite et à température élevée, ou par cristallisation à partir d'une solution contenant un solvant organique. Le sel exempt d'eau fond à 172-174 °C. L'analyse chimique indique 10,50 % en poids de magnésium (10,55 % en poids de magnésium calculé). Toutes les modifications sont non hygroscopiques et stables pendant le stockage. 1 g de sel de magnésium se dissout dans 2 ml d'eau à température ambiante, le pH de la solution aqueuse est de 7. Il se dissout facilement dans l'eau, le méthanol et l'éthanol, il ne se dissout pas dans l'éther et les hydrocarbures, il n'est pas hygroscopique, il est stockable et a une odeur aromatique agréable.
Ce sel de magnésium contient environ 5 moles d'eau d'hydratation. Il n'est pas hydroscopique, est stable et peut être stocké pendant des périodes arbitrairement longues. En séchant pendant plusieurs heures entre 40 °C et 50 °C, il perd une partie de son eau de cristallisation (1 mole) et fond alors à 118 °C ou 120 °C. Le 4-hydroxybutyrate de magnésium exempt d'eau peut être produit par élimination de l'eau par sublimation et/ou évaporation de l'eau sous une pression partielle d'eau réduite et à température élevée, ou par cristallisation à partir d'une solution contenant un solvant organique. Le sel exempt d'eau fond à 172-174 °C. L'analyse chimique indique 10,50 % en poids de magnésium (10,55 % en poids de magnésium calculé). Toutes les modifications sont non hygroscopiques et stables pendant le stockage. 1 g de sel de magnésium se dissout dans 2 ml d'eau à température ambiante, le pH de la solution aqueuse est de 7. Il se dissout facilement dans l'eau, le méthanol et l'éthanol, il ne se dissout pas dans l'éther et les hydrocarbures, il n'est pas hygroscopique, il est stockable et a une odeur aromatique agréable.
Autres sels.
Les sels de lithium et d'ammonium du GHB seraient dangereux à ingérer. L'ion lithium est toxique et, avec le NH3 lactone, il se transforme en pyrrolidone.
Questions et réponses sur la synthèse.
Q : Puis-je utiliser de la soude au lieu de l'hydroxyde de sodium pur ?
R : Non, cela pourrait avoir des effets imprévisibles sur votre santé. La soude de la quincaillerie est loin d'avoir les critères de pureté rigoureux de la soude alimentaire, de la soude ACS ou de la soude électronique, par exemple. Certaines personnes racontent des histoires réussies en utilisant de la soude, ce qui est vraiment possible, mais comme nous l'avons dit, les résultats sont imprévisibles.
Q : Je n'ai pas la verrerie dont vous dites qu'elle est nécessaire, puis-je faire bouillir la solution dans une casserole sur la cuisinière à la place ?
R : Non, vous ne le pouvez pas. L'hydroxyde de sodium corrodera le métal et des ions métalliques divers se retrouveront dans votre produit. Vous pouvez, bien sûr, utiliser une verrerie plus simple que dans mes suggestions, et faire les ajustements nécessaires à la procédure.
Q : Je ne peux pas recristalliser le Na-GHB à partir de l'éthanol. Il forme une masse collante.
R : Votre Na-GHB n'est pas sec, ou votre éthanol n'est pas anhydre. L'eau rend la recristallisation presque impossible. Le fait que le GHB sodique soit déliquescent (hygroscopique) n'arrange pas les choses. Vous devez sécher complètement le GHB, de préférence dans un dessiccateur sous vide, avant de tenter une recristallisation ou toute autre alternative improvisée. L'éthanol que vous envisagez d'utiliser (le plus souvent fourni avec une pureté de 95 %, le reste étant de l'eau) doit être séché par séchage sur du sulfate de calcium anhydre suivi d'une distillation à partir d'oxyde de calcium, des mesures adéquates étant prises pour exclure l'humidité de la réaction.
Q : Où puis-je acheter du butyrolactone/est-il sûr d'acheter du butyrolactone ?
R : Je n'ai aucune idée de la situation qui prévaut dans votre pays. Les réponses à ces questions dépendent fortement de qui vous êtes et de l'endroit où vous vivez. Toutefois, vous pouvez contacter l'un des nombreux vendeurs de kits de GHB que l'on peut trouver en ligne.
R : Non, cela pourrait avoir des effets imprévisibles sur votre santé. La soude de la quincaillerie est loin d'avoir les critères de pureté rigoureux de la soude alimentaire, de la soude ACS ou de la soude électronique, par exemple. Certaines personnes racontent des histoires réussies en utilisant de la soude, ce qui est vraiment possible, mais comme nous l'avons dit, les résultats sont imprévisibles.
Q : Je n'ai pas la verrerie dont vous dites qu'elle est nécessaire, puis-je faire bouillir la solution dans une casserole sur la cuisinière à la place ?
R : Non, vous ne le pouvez pas. L'hydroxyde de sodium corrodera le métal et des ions métalliques divers se retrouveront dans votre produit. Vous pouvez, bien sûr, utiliser une verrerie plus simple que dans mes suggestions, et faire les ajustements nécessaires à la procédure.
Q : Je ne peux pas recristalliser le Na-GHB à partir de l'éthanol. Il forme une masse collante.
R : Votre Na-GHB n'est pas sec, ou votre éthanol n'est pas anhydre. L'eau rend la recristallisation presque impossible. Le fait que le GHB sodique soit déliquescent (hygroscopique) n'arrange pas les choses. Vous devez sécher complètement le GHB, de préférence dans un dessiccateur sous vide, avant de tenter une recristallisation ou toute autre alternative improvisée. L'éthanol que vous envisagez d'utiliser (le plus souvent fourni avec une pureté de 95 %, le reste étant de l'eau) doit être séché par séchage sur du sulfate de calcium anhydre suivi d'une distillation à partir d'oxyde de calcium, des mesures adéquates étant prises pour exclure l'humidité de la réaction.
Q : Où puis-je acheter du butyrolactone/est-il sûr d'acheter du butyrolactone ?
R : Je n'ai aucune idée de la situation qui prévaut dans votre pays. Les réponses à ces questions dépendent fortement de qui vous êtes et de l'endroit où vous vivez. Toutefois, vous pouvez contacter l'un des nombreux vendeurs de kits de GHB que l'on peut trouver en ligne.
Les précurseurs.
Le précurseur évident pour la synthèse du GHB est le gamma-butyrolactone. Il peut être fabriqué à partir de pré-précurseurs tels que le tétrahydrofurane (THF) avec des oxydants tels que le tétroxyde de ruthénium, l'hypochlorite de calcium et l'acide nitrique. Les dérivés de l'acide 4-halo-butyrique (chloro, bromo, iodo) peuvent également être utilisés. Comme dans la synthèse ci-dessous, ils peuvent être convertis en gamma-butyrolactone par distillation avec du méthoxyde de sodium.
gamma-butyrolactone à partir de l'acide 4-bromobutyrique.
A une solution de 7,8 g de sodium dans 500 ml d'alcool absolu, on a ajouté 60,5 g d'acide 4-bromobutyrique. Le mélange réactionnel a été porté à ébullition sous un condenseur à reflux pendant environ cinq heures. Pendant ce temps, le bromure de sodium s'est séparé. L'alcool a été distillé dans un bain de vapeur et la lactone a été séparée du bromure de sodium par extraction à l'éther. L'éther a été évaporé et la lactone distillée sous pression ordinaire. Le rendement était de 21,2 grammes (67 %) de produit bouillant à 202-206 °C. Une alternative peut être la chloration radicale libre de l'acide butyrique avec du chlorure de soufre en présence de peroxydes, et la séparation des isomères par distillation, la fabrication du sel de sodium de l'acide 4-chlorobutyrique, et la cyclisation jusqu'à la lactone comme pour le dérivé 4-bromo ci-dessus. Le gamma-butyrolactone peut également être fabriqué à partir de l'acide 4-méthoxybutyrique, du 3-phénoxypropylcyanide, de l'acide gamma-diéthylaminobutyrique et de l'éther vinylique bêta-chloroéthylique, ainsi que de nombreux autres produits chimiques un peu trop exotiques. Industriellement, il est généralement fabriqué en faisant réagir l'acétylène avec le formaldéhyde à des températures et des pressions élevées.
Déshydrogénation du 1,4-butanediol (BDO) en gamma-butyrolactone (GBL).
Un mélange de 90,1 g (1 mole) de 1,4-butanediol, de 4 g de catalyseur en chromite de cuivre et de 0,15 g d'hydroxyde de sodium de qualité réactif en poudre (ou mieux de KOH) a été agité vigoureusement et chauffé à reflux. À environ 200 °C, un vif dégagement d'hydrogène s'est produit, la température a baissé d'environ 10 °C et la déshydrogénation s'est déroulée sans heurts. Ledégagement de gaz (39 L/2 mol par mole de 1,4-butanediol réagi) a cessé en 3 heures environ. Le mélange réactionnel a été refroidi à température ambiante, filtré du catalyseur et distillé sous pression réduite pour donner du gamma-butyrolactone avec un rendement d'environ 80 % et du 1,4-butanediol n'ayant pas réagi avec un rendement d'environ 10 %.
Préparation d'un catalyseur de déshydrogénation à base de chromite de cuivre hautement actif.
Une solution de 260 g de nitrate de cuivre(II) trihydraté dans 900 ml d'eau du robinet à 80 °C a été ajoutée sous agitation à une solution de 178 g de bichromate de sodium dihydraté et à 225 ml de NH4OH à 28 %, portée à 900 ml à 25 °C. Le précipité a été recueilli par filtration par aspiration et passé trois fois dans de l'eau. Le chromate de cuivre et d'ammonium a été séché à 75-80 °C pendant une nuit. Il a été réduit en poudre et ajouté par petites portions à un ballon d'un litre à 3 cols équipé d'un agitateur en acier inoxydable de type Hershberg qui raclait près du fond du ballon. Le ballon a été partiellement immergé dans un bain d'huile à 350 °C (avec 300-320 °C, on peut obtenir de bons résultats). Le temps d'addition a été de 15 minutes (beaucoup de fumées se sont dégagées) et le mélange a été agité à 350 °C pendant encore 15 minutes après que tout soit terminé. La poudre noire et poussiéreuse refroidie est utilisée telle quelle pour la déshydrogénation.
Une solution de 260 g de nitrate de cuivre(II) trihydraté dans 900 ml d'eau du robinet à 80 °C a été ajoutée sous agitation à une solution de 178 g de bichromate de sodium dihydraté et à 225 ml de NH4OH à 28 %, portée à 900 ml à 25 °C. Le précipité a été recueilli par filtration par aspiration et passé trois fois dans de l'eau. Le chromate de cuivre et d'ammonium a été séché à 75-80 °C pendant une nuit. Il a été réduit en poudre et ajouté par petites portions à un ballon d'un litre à 3 cols équipé d'un agitateur en acier inoxydable de type Hershberg qui raclait près du fond du ballon. Le ballon a été partiellement immergé dans un bain d'huile à 350 °C (avec 300-320 °C, on peut obtenir de bons résultats). Le temps d'addition a été de 15 minutes (beaucoup de fumées se sont dégagées) et le mélange a été agité à 350 °C pendant encore 15 minutes après que tout soit terminé. La poudre noire et poussiéreuse refroidie est utilisée telle quelle pour la déshydrogénation.
Synthèse de la gamma-butyrolactone à partir du tétrahydrofurane (THF).
A un mélange agité de 7,2 g (0,1 mol) de tétrahydrofurane dans 100 ml d'eau, on a ajouté 15,1 g de bromate de sodium et 13,6 g (0,1 mol) d'hydrogénosulfate de potassium. Un refroidissement externe a été nécessaire pour maintenir la température de la solution entre 25 et 30 °C. L'agitation s'est poursuivie pendant 16 heures à température ambiante, après quoi tout le THF a été consommé. Pour éteindre tout excès de brome formé, une solution acide de sulfite de sodium a été utilisée [le bisulfite devrait fonctionner tout aussi bien]. Ainsi, 140-150 ml d'une solution à 10% ont été ajoutés et 13,6 g (0,1 mol) d'hydrogénosulfate de potassium. La réaction a été refroidie et extraite avec 5x30 ml de dichlorométhane. Les couches organiques combinées ont été séchées sur MgSO4 et le solvant a été éliminé sous vide. Lerésidu a été distillé pour donner du gamma-butyrolactone avec un rendement de 73% (bp 204-205 °C).
Réaction de Sandmeyer du GABA au GBL/GHB.
Elle est géniale pour un chimiste qui souhaite préparer du GHB en petites quantités et avec des rendements élevés, et ce sans obtenir directement des produits chimiques réglementés tels que le gamma-butyrolactone (GBL) ou le 1,4-butanediol (BDO). Elle permet également d'éviter les faibles rendements typiques de l'oxydation du tétrahydrofurane (THF). Il utilise un acide aminé facile à obtenir, l'acide gamma-aminobutyrique (GABA), et du nitrite de sodium (NaNO2). Il s'échelonne très bien et fonctionne sans trop de problèmes. Aucun produit chimique suspect n'est utilisé.
La réaction de Sandmeyer utilise l'acide nitreux pour transformer les amines en sels de diazonium. Cette réaction, telle qu'elle s'applique à la transformation du GABA en GHB, est illustrée dans la première réaction ci-dessous. Les sels de diazonium aliphatiques subissent rapidement une hydrolyse en présence d'eau, en dégageant de l'azote gazeux et en laissant un groupe hydroxyle. Ce phénomène est illustré dans la deuxième étape. Grâce à ces réactions, le GABA peut être transformé en GHB dans une réaction facile à réaliser en une seule étape.
Exécuter la réaction.
Préparez un ballon de 2 litres, placé dans de l'eau glacée au-dessus d'un agitateur magnétique. Maintenant.
Exécuter la réaction.
Préparez un ballon de 2 litres, placé dans de l'eau glacée au-dessus d'un agitateur magnétique. Maintenant.
- Ajouter 3mol de GABA (309,4 g).
- Ajouter 3mol deNaNO2 (207,0 g).
- Ajouter 700 ml d'eau (le volume total devient environ 1100 ml).
- Introduire une barre d'agitation de 1" et commencer à agiter.
- Chargez un entonnoir d'addition à pression égale de 500 ml avec 3,3 mol HCl(aq) (385,0 g 31,25%, 334,8 ml 31,25%).
- Equiper l'entonnoir d'addition d'un adaptateur de sortie de gaz et ventiler à l'extérieur.
Commencez à faire couler lentement l'acide chlorhydrique dans le mélange. Faites-le couler à un rythme constant d'environ 1 goutte toutes les 2 à 5 secondes. Accélérez au fur et à mesure que le temps passe et remplacez la glace si nécessaire, mais ne laissez pas l'évolution du gaz brun toxique devenir vigoureuse. Environ une heure après l'ajout de la dernière goutte d'acide, il n'est plus nécessaire de remplacer la glace. Une fois la réaction terminée, procéder à l'extraction. (généralement 24 à 36 heures plus tard)
Extraction.
Il existe de nombreuses possibilités. Il s'agit encore d'un travail en cours, mais après environ 20 essais, j'en suis venu à utiliser ce travail. Vous pouvez utiliser de l'acétate d'éthyle (EtOAc), du chloroforme ou du chlorure de méthylène (dichlorométhane ou DCM) pour effectuer les extractions par solvant. J'ai normalement utilisé le DCM car la couche organique tombe au fond de l'ampoule à décanter.
1. Préparation d'une distillation simple
Extraction.
Il existe de nombreuses possibilités. Il s'agit encore d'un travail en cours, mais après environ 20 essais, j'en suis venu à utiliser ce travail. Vous pouvez utiliser de l'acétate d'éthyle (EtOAc), du chloroforme ou du chlorure de méthylène (dichlorométhane ou DCM) pour effectuer les extractions par solvant. J'ai normalement utilisé le DCM car la couche organique tombe au fond de l'ampoule à décanter.
1. Préparation d'une distillation simple
a) Distiller, en jetant les 5-10 premiers ml de distillat car ils contiennent une bonne quantité d'oxydes nitriques. Distiller autant d'eau que possible, essentiellement jusqu'à ce que le chlorure de sodium commence à saturer la couche aqueuse et à précipiter.
b) Le reste du distillat (environ 700 ml) contient environ 1 g de GBL/10 ml.
c) Traiter le reste du distillat avec NaHCO3 à reflux pendant 30 minutes.
d) Faire bouillir avec un volume d'environ 5 % de charbon actif (soit 0,35 ml de charbon actif) (par rapport au volume de la solution) pendant 5 à 10 minutes.
e) Laisser refroidir et filtrer, laver le charbon avec de l'eau distillée. Conserver le NaGHB.
2. Avec le reste de la solution aqueuse, extraire 5 fois avec des portions de 625 ml de DCM.
3. Distiller le DCM (réutiliser le DCM !).
4. Distiller le GBL (sous vide si possible).
5. Réagir avec NaHCO3 et de l'eau distillée et traiter avec du charbon actif comme précédemment.
En règle générale, 375 g de NaGHB sont fabriqués à partir du GBL extrait du solvant, dont 100 g de NaGHB à partir du distillat aqueux. Bien que la conversion soit presque quantitative (mesurée par GC/MS), le rendement global récupéré est généralement d'environ 70 %.
3. Distiller le DCM (réutiliser le DCM !).
4. Distiller le GBL (sous vide si possible).
5. Réagir avec NaHCO3 et de l'eau distillée et traiter avec du charbon actif comme précédemment.
En règle générale, 375 g de NaGHB sont fabriqués à partir du GBL extrait du solvant, dont 100 g de NaGHB à partir du distillat aqueux. Bien que la conversion soit presque quantitative (mesurée par GC/MS), le rendement global récupéré est généralement d'environ 70 %.
Last edited:
