G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,659
- Solutions
- 3
- Reaction score
- 2,734
- Points
- 113
- Deals
- 1
Sissejuhatus.
See fail käsitleb GHB ja sellega seotud ühendite sünteesi. GHB sünteesi katsetamine on väga ohtlik ilma praktilise orgaanilise keemia nõuetekohaste teadmisteta. Kõige lihtsam viis GHB tootmiseks on vastava laktooni (tsükliline intramolekulaarne ester) hüdrolüüs soovitud hüdroksühappeks. Esteri hüdrolüüsi saab teha kahel viisil: Happe poolt katalüüsitud reaktsioon või aluse poolt katalüüsitud reaktsioon. Meie valik on siinkohal aluskatalüüsitud reaktsioon, sest reaktsioon ei ole pöörduv nagu happekatalüüsitud reaktsioon ja seetõttu saame suurema saagise ning saame GHB naatriumsoola, kuna vaba hape ei ole stabiilne ja tsükliseerub kohe uuesti gammabutürolaktooniks.
Gamma-butürolaktooni muundamine naatrium-gammabutüraadiks (Na-GHB).
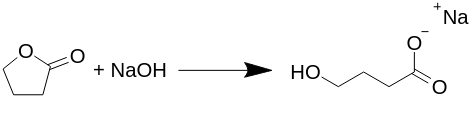
Reaktsioon kulgeb ekvivalentselt (iga molekul reageerib võrdselt) ja selles reaktsioonis ei teki kõrvalsaadusi, nagu vesinikgaas, vesi või midagi muud, nagu on pakutud mitmes teises tekstis. Kõik avaldatud GHB või õigemini Na-GHB preparaadid refluksivad butürolaktooni naatriumhüdroksiidiga erinevates lahustites, tavaliselt vesialkoholiga, kuid see ei ole vajalik.
Füüsikalised/keemilised omadused.
gamma-butürolaktoon.
Mol mass 86,09; mp -43,53 °C; bp 204°C; d 1,12 g/ml
CAS nr: [96-48-0]
Seguneb veega, lahustub metanoolis, etanoolis, atsetoonis, eetris, benseenis
LD50: 1720 mg/kg (suu kaudu, hiir) 1540 mg/kg (suu kaudu, rott)
Kasutamine:
Sünonüümid: lahusti, värvieemaldaja, kondensaatorite elektrolüüt, orgaanilises keemias Sünonüümid: GBL, BLO, butürolaktoon, gammahüdroksübutaanhappe laktoon, 1,2-butanool, 1,4-butanool, 4-butanool, 2-oksanool, tetrahüdro-2-furanoon, dihüdro-2(3H)-furanoon.
Sodium GHB.
Mol mass 126,09; mp 145-146 °C
CAS nr: [502-85-2]
LD50:2700 mg/kg (suukaudselt, rott)
Sünonüümid: Gamma-OH, naatriumoksübaat, naatriumgammakoksübutüraat, Somatomax PM, Wy-3478, NSC-84223, Somsanit, Anetamiin.
Kaalium GHB.
Mol wt: 142,20
Kaltsium GHB.
Molmass 246,16; mp 164-166 °C, 166-168 °C.
Magneesium GHB.
Molmass 230,39; mp (veevaba) 172-174 °C; tetrahüdraat 118-120 °C; pentahüdraat 76-78 °C.
Mol mass 86,09; mp -43,53 °C; bp 204°C; d 1,12 g/ml
CAS nr: [96-48-0]
Seguneb veega, lahustub metanoolis, etanoolis, atsetoonis, eetris, benseenis
LD50: 1720 mg/kg (suu kaudu, hiir) 1540 mg/kg (suu kaudu, rott)
Kasutamine:
Sünonüümid: lahusti, värvieemaldaja, kondensaatorite elektrolüüt, orgaanilises keemias Sünonüümid: GBL, BLO, butürolaktoon, gammahüdroksübutaanhappe laktoon, 1,2-butanool, 1,4-butanool, 4-butanool, 2-oksanool, tetrahüdro-2-furanoon, dihüdro-2(3H)-furanoon.
Sodium GHB.
Mol mass 126,09; mp 145-146 °C
CAS nr: [502-85-2]
LD50:2700 mg/kg (suukaudselt, rott)
Sünonüümid: Gamma-OH, naatriumoksübaat, naatriumgammakoksübutüraat, Somatomax PM, Wy-3478, NSC-84223, Somsanit, Anetamiin.
Kaalium GHB.
Mol wt: 142,20
Kaltsium GHB.
Molmass 246,16; mp 164-166 °C, 166-168 °C.
Magneesium GHB.
Molmass 230,39; mp (veevaba) 172-174 °C; tetrahüdraat 118-120 °C; pentahüdraat 76-78 °C.
GHB-soolade sünteesi laboratoorsed menetlused.
Palun järgige üldisi laboratoorset ohutusmenetlust. Kandke laborikabuuri ja kaitseprille. Te töötate kuumade söövitavate lahuste ja lahustitega! Olge teadlik GHB valmistamisega seotud ohtudest! Ärge kunagi töötage üksi!
Naatrium-GHB.
Menetlus:
Lahustage 130 grammi (3,25 mooli) puhast naatriumhüdroksiidi 400 ml destilleeritud vees 1000 ml kolmekaelases ümarpõhjalises kolvis segades. Lahustumine on eksotermiline ja lahus kuumeneb. Temperatuuri reguleerimiseks võib kasutada külma veevanni. Kui kõik on lahustunud selgeks lahuseks, lisatakse aeglaselt ja hästi segades 250 ml (280 g, 3,25 mooli) gammabutürolaktooni 50 ml kaupa. Soovitatav on kasutada tilgutuslehtrit. Gammabutürolaktooni lisamine naatriumhüdroksiidi lahusele on samuti eksotermiline ja kui seda liiga kiiresti lisada, hakkab lahus keema ja seda me ei taha. Jälgige temperatuuri uputustermomeetriga. Gammabutürolaktooni lisamine võtab aega 20-30 minutit. Kui kõik on lisatud, laske segul reageerida veel 10 minutit, aeg-ajalt segades.
Nüüd on aeg näha, kas reaktsioon on lõpule jõudnud, kontrollides pH-d universaalse pH-paberiga. Meie eesmärk on saavutada pH 7-8. Kui see on liiga kõrge (pH > 8), siis lisage 10 ml gammabutürolaktooni ja laske veel mõned minutid reageerida. Kui pH on liiga madal (pH < 7), lisage mõned ml kontsentreeritud NaOH vesilahust. Jätkata niimoodi, kuni pH on soovitud piirides.
Lahus on täiesti selge ja maitseb kergelt soolase maitsega. See võib olla kergelt kollase värvusega, kuid mitte palju, kui kasutati piisavalt puhast butürolaktooni (laktooni destilleerimine enne kasutamist kõrvaldab selle probleemi, b.p. 204 °C). Kui liiga aluselise lahuse neutraliseerimiseks kasutatakse hapet (selle asemel, et lisada rohkem laktooni), võivad lahuses sadestuda happe naatriumsoola kristallid ja maitse on tugevalt halvenenud. Lõplikuks lahuseks on umbes 750 ml, 50% NaGHB. Lahust võib kontsentreerida (keetmise teel) kuni ~600 ml-ni, ilma et see toatemperatuuril kristalliseeruks, kuid kui kontsentreerida kuni ~500 ml-ni, tahkestub see alati.
Nüüd on aeg näha, kas reaktsioon on lõpule jõudnud, kontrollides pH-d universaalse pH-paberiga. Meie eesmärk on saavutada pH 7-8. Kui see on liiga kõrge (pH > 8), siis lisage 10 ml gammabutürolaktooni ja laske veel mõned minutid reageerida. Kui pH on liiga madal (pH < 7), lisage mõned ml kontsentreeritud NaOH vesilahust. Jätkata niimoodi, kuni pH on soovitud piirides.
Lahus on täiesti selge ja maitseb kergelt soolase maitsega. See võib olla kergelt kollase värvusega, kuid mitte palju, kui kasutati piisavalt puhast butürolaktooni (laktooni destilleerimine enne kasutamist kõrvaldab selle probleemi, b.p. 204 °C). Kui liiga aluselise lahuse neutraliseerimiseks kasutatakse hapet (selle asemel, et lisada rohkem laktooni), võivad lahuses sadestuda happe naatriumsoola kristallid ja maitse on tugevalt halvenenud. Lõplikuks lahuseks on umbes 750 ml, 50% NaGHB. Lahust võib kontsentreerida (keetmise teel) kuni ~600 ml-ni, ilma et see toatemperatuuril kristalliseeruks, kuid kui kontsentreerida kuni ~500 ml-ni, tahkestub see alati.
Naatrium-GHB valmistamine naatriumvesinikkarbonaadi (naatriumisooda, NaHCO3) abil.
Lisatakse 273 g NaHCO3 (3,25 mooli) 1125 ml destilleeritud veele kolmekaelases ümarpõhjalises kolvis. Lahus viiakse aeglaselt keemiseni, samal ajal segades klaasist vardaga vms. Kogu söögisooda lahustub. Süsinikdioksiid väljub lahusest keema tõustes. See on naatriumbikarbonaadi lagunemine veidi tugevaks aluseks, naatriumkarbonaadiks.
Vähendage kuumust kergele keemisele ja lisage aeglaselt 250 ml gamma-butürolaktooni (280 g, 3,25 mooli). Lisamine ei ole kohe eksotermiline, nagu naatriumhüdroksiidi sünteesi puhul. Hoidke seda lahust 30 minutit kergel keemisel. Kontrollida pH-d universaalse pH-paberiga. Meie eesmärk on saavutada pH ligikaudu 7, kuid kõik 6-8 on täiesti ohutu. Kui pH on liiga kõrge, lisage veidi rohkem GBLi ja jätkake tagasivoolamist.
Lahus on täiesti selge ja peaks olema täiesti värvitu. Kui lahus ei ole täiesti värvitu, st kui kasutati veidi ebapuhtat butürolaktooni ja lahus on omandanud helekollase värvuse, lisage umbes 100 ml aktiivsütt. Laske sellel 10 minutit keeta. Lahus jahutatakse, seejärel filtreeritakse, pestes aktiivsütt kaks või kolm korda 50 ml külma veega. Selle sünteesi käigus saadakse 410 g NaGHB-d. Seda lahust võib kontsentreerida umbes 50 % NaGHB-ni, enne kui see hakkab kristalliseeruma. Kui soovite pulbrit, kuumutage, kuni lahuse temperatuur on 150 °C, seejärel valage see jahtunud Pyrex-kaussi ja laske sellel jahtuda ja tahkuda. See süntees sobib ideaalselt kasutamiseks, kui ei ole saadaval ACS-, toidu- või elektroonikaklassi naatriumhüdroksiidi.
Lahus on täiesti selge ja peaks olema täiesti värvitu. Kui lahus ei ole täiesti värvitu, st kui kasutati veidi ebapuhtat butürolaktooni ja lahus on omandanud helekollase värvuse, lisage umbes 100 ml aktiivsütt. Laske sellel 10 minutit keeta. Lahus jahutatakse, seejärel filtreeritakse, pestes aktiivsütt kaks või kolm korda 50 ml külma veega. Selle sünteesi käigus saadakse 410 g NaGHB-d. Seda lahust võib kontsentreerida umbes 50 % NaGHB-ni, enne kui see hakkab kristalliseeruma. Kui soovite pulbrit, kuumutage, kuni lahuse temperatuur on 150 °C, seejärel valage see jahtunud Pyrex-kaussi ja laske sellel jahtuda ja tahkuda. See süntees sobib ideaalselt kasutamiseks, kui ei ole saadaval ACS-, toidu- või elektroonikaklassi naatriumhüdroksiidi.
Kaalium GHB.
Kasutage eespool kirjeldatud etanoolisünteesi naatrium-GHB jaoks, kuid asendage 130 grammi NaOH 182 grammi KOH-ga (see arvutus põhineb raskemal K aatomil ja KOH suurema veesisalduse tõttu võrreldes NaOH-ga). KOH kasutamine annab K-GHB kasutajatele selle kaaliumilisandi, mida mõned ütlevad, et seda on vaja seoses GHB manustamisega. Pidage meeles, et (pulbriline) K-GHB on veidi vähem aktiivne (massi järgi) kui Na-GHB, kuna K-ioon on raskem kui Na-ioon. K-GHB ja Na-GHB erinevused seisnevad selles, et K-sool on vees paremini lahustuv kui Na-sool ja maitse on Na-GHB soolase/seebi asemel pigem soolase/seebi maitse.
Kaltsium-GHB.
74 g analüütiliselt puhast kaltsiumhüdroksiidi suspendeeritakse 200 ml destilleeritud vees. Sellele toatemperatuuril olevale suspensioonile lisatakse 160 ml 4-butürolaktooni osade kaupa (iga osa umbes 5-10 ml) ja segades. Pärast 20 ml lisamist soojendatakse reaktsioonisegu umbes 50 °C kuni 60 °C. 4-butürolaktooni lisamist kontrollitakse nii, et temperatuur jääb umbes 50 °C ja 60 °C vahele, mis võtab aega umbes 1 tund. Selle aja jooksul on kaltsiumhüdroksiid praktiliselt täielikult lahustunud. Reaktsioonimaterjal on saastunud kerge roostekollase sademega. Seda lahjendatakse 300 ml metanooliga, jäetakse neljaks tunniks seisma ja seejärel filtreeritakse läbi volditud filtri. Selget filtraati töödeldakse ettevaatlikult 200 ml atsetooniga nii, et pärast iga sette tekitava atsetoonikoguse andmist antakse aega sette uuesti lahustumiseks. Saadakse veepuhas lahus, mis pannakse kristalliseerumiseks. Kahe tunni seismise järel hakkavad ladestuma värvitud kristallid. Selles olekus kiirendatakse kristalliseerumist atsetooni pideva lisamisega (kokku 100 ml). Kristalliseerumise aeg on 24 tundi. Kristallid imetakse maha ja neid pestakse esialgu 50 ml metanooliga ja seejärel täiendavalt 60 ml atsetooniga. Kristallid kuivatatakse kuivatuskapis temperatuuril umbes 60 °C kuni 80 °C. Saagis: 230 g. Sulamistemperatuur 166-168 °C. (kohe). Toode on 4-hüdroksüvõihappe veevaba mittehügroskoopiline kaltsiumsool. See on vees lahustuv nagu soovitud, vesilahuse pH- väärtus on 7-7,5. Soola võib säilitada nii kaua kui soovitakse ja see ei muutu õhus. Isegi ladustamisel ei tõmba õhust vett.
Jääk kristalliseerub värvusetu kristallide massiks, mis pärast kuivatamist temperatuuril umbes 60 °C kuni 80 °C kuivatatakse. Saagis: umbes 105 g. Sulamistemperatuur 164-166 °C. Toode on di-(4-hüdroksübutüri)kaltsium. Ümberkristallitakse, lahustades seda väheses metanoolis, seejärel lisatakse hägususeni atsetooni ja kristalliseerub külmas.
Metanooli asemel võib sama edukalt kasutada ümberkristalliseerimiseks ka etanooli ja isopropanooli. Ilma vett sisaldavate alkoholide kasutamiseta ümberkristallisatsioonikeskkonnana või ümberkristalliseerimise ja puhastamise lisandina ei saada stabiilseid ja eriti mittehügroskoopilisi kaltsiumsoolasid. Alkoholide veesisaldus peaks olema umbes 3-10 mahuprotsenti. Selliselt saadud lõpptoode lahustub kergesti vees, ei ole hüdroskoopiline ja sellel on meeldiv aromaatne lõhn.
Jääk kristalliseerub värvusetu kristallide massiks, mis pärast kuivatamist temperatuuril umbes 60 °C kuni 80 °C kuivatatakse. Saagis: umbes 105 g. Sulamistemperatuur 164-166 °C. Toode on di-(4-hüdroksübutüri)kaltsium. Ümberkristallitakse, lahustades seda väheses metanoolis, seejärel lisatakse hägususeni atsetooni ja kristalliseerub külmas.
Metanooli asemel võib sama edukalt kasutada ümberkristalliseerimiseks ka etanooli ja isopropanooli. Ilma vett sisaldavate alkoholide kasutamiseta ümberkristallisatsioonikeskkonnana või ümberkristalliseerimise ja puhastamise lisandina ei saada stabiilseid ja eriti mittehügroskoopilisi kaltsiumsoolasid. Alkoholide veesisaldus peaks olema umbes 3-10 mahuprotsenti. Selliselt saadud lõpptoode lahustub kergesti vees, ei ole hüdroskoopiline ja sellel on meeldiv aromaatne lõhn.
Magneesium GHB .
60 g magneesiumhüdroksiidi (analüütiline kvaliteet) suspendeeritakse 200 ml kraanivees segades. Sellesse suspensiooni segatakse voolu ja segamise all 160 ml butürolaktooni. Seejärel kuumutatakse segu vesivannil 6 tundi segamise all 2-liitrises kolvis. Magneesiumhüdroksiid lahustub praktiliselt täielikult. Kolbil lastakse seisma jääda üleöö, samal ajal kui saasteained ladestuvad ja lahus dekanteeritakse vaevata saasteainete ladestumisest. Veepuhast dekanteeritud lahust segatakse esialgu 10 minutit 100 ml atsetooniga. Värvitu siirupitaoline vedelik, mis on nüüd muutunud viskoossemaks, segatakse uuesti 100 ml atsetooniga, nagu eespool kirjeldatud, atsetoon eemaldatakse taas dekanteerimise teel ja üsna viskoosne, värvitu siirup jäetakse toatemperatuuril umbes 2-4 tunniks iseenesest. See tahkestub värvituks kristalliliseks massiks, mis peenestatakse mörsris ja kuivatatakse mitu tundi õhu käes. Sulamistemperatuur on 76-78 °C. Saagis: 314 g analüütiliselt puhtal kujul.
See magneesiumsool sisaldab umbes 5 mooli hüdratsioonivett. See ei ole hüdroskoopiline, on stabiilne ja seda võib säilitada suvaliselt kaua. Mitme tunni jooksul 40 °C kuni 50 °C juures kuivatades kaotab ta osa oma kristalliseerumisveest (1 mooli) ja sulab seejärel 118 °C kuni 120 °C juures. Veevaba magneesium-4-hüdroksübutüraati saab valmistada vee eemaldamise teel veesublimatsiooni ja/või aurustamiseteel vee vähenenud osarõhu all ja kõrgenenud temperatuuril või kristalliseerumise teel orgaanilist lahustit sisaldavast lahusest. Veevaba sool sulab temperatuuril 172-174 °C. Keemiline analüüs näitab 10,50 massiprotsenti magneesiumi (arvutuslikult 10,55 massiprotsenti magneesiumi). Kõik modifikatsioonid on mittehügroskoopilised ja ladustamise ajal stabiilsed. 1 g magneesiumsoola lahustub toatemperatuuril 2 ml vees, vesilahuse pH on 7. See lahustub kergesti vees, metanoolis ja etanoolis, ei lahustu eetris ja süsivesinikes, ei ole hügroskoopiline, on säilitatav ja meeldiva aromaatse lõhnaga.
See magneesiumsool sisaldab umbes 5 mooli hüdratsioonivett. See ei ole hüdroskoopiline, on stabiilne ja seda võib säilitada suvaliselt kaua. Mitme tunni jooksul 40 °C kuni 50 °C juures kuivatades kaotab ta osa oma kristalliseerumisveest (1 mooli) ja sulab seejärel 118 °C kuni 120 °C juures. Veevaba magneesium-4-hüdroksübutüraati saab valmistada vee eemaldamise teel veesublimatsiooni ja/või aurustamiseteel vee vähenenud osarõhu all ja kõrgenenud temperatuuril või kristalliseerumise teel orgaanilist lahustit sisaldavast lahusest. Veevaba sool sulab temperatuuril 172-174 °C. Keemiline analüüs näitab 10,50 massiprotsenti magneesiumi (arvutuslikult 10,55 massiprotsenti magneesiumi). Kõik modifikatsioonid on mittehügroskoopilised ja ladustamise ajal stabiilsed. 1 g magneesiumsoola lahustub toatemperatuuril 2 ml vees, vesilahuse pH on 7. See lahustub kergesti vees, metanoolis ja etanoolis, ei lahustu eetris ja süsivesinikes, ei ole hügroskoopiline, on säilitatav ja meeldiva aromaatse lõhnaga.
Muud soolad.
GHB liitium- ja ammooniumsoolad oleksid ohtlikud allaneelamisel. Liitium-ioon on mürgine ja koos NH3-laktooniga muutub pürrolidooniks.
Süntees Küsimused ja vastused.
K: Kas ma võin puhta naatriumhüdroksiidi asemel kasutada leelist?
V: Ei, see võib teie tervisele ettearvamatuid tulemusi anda. Riistvarapoodide leelisel ei ole kaugeltki nii rangeid puhtusekriteeriume kui näiteks toiduainetele, ACS-klassile või elektroonikaklassile. Mõned inimesed räägivad edukatest lugudest, kasutades leelist, mis on tõesti võimalik, kuid nagu öeldud, on tulemused ettearvamatud.
K: Mul ei ole klaasnõusid, mida te ütlete, et need on vajalikud, kas ma võin selle asemel lahust keeta potis pliidil?
V: Ei, ei saa. Naatriumhüdroksiid söövitab metalli ja teie tootesse satuvad mitmesugused metalliioonid. Te võite muidugi kasutada lihtsamaid klaasnõusid kui minu soovitustes ja teha vajalikud kohandused menetluses.
K: Ma ei saa Na-GHB-d etanoolist ümberkristalliseerida. See moodustab kleepuva jama.
V: Teie Na-GHB ei ole kuiv või teie etanool ei ole veevaba. Vesi muudab ümberkristalliseerimise peaaegu võimatuks. Asjaolu, et naatrium-GHB on veelduv (hügroskoopiline), ei tee seda paremaks. Enne ümberkristalliseerimise katsetamist või muud improviseeritud alternatiivi tuleb GHB põhjalikult kuivatada, eelistatavalt vaakumeksikaatoris. Etanool, mida te kavatsete kasutada (enamasti tarnitakse puhtusastmega 95%, ülejäänu on vesi), tuleb kuivatada kuivatamise teel veevaba kaltsiumsulfaadi kohal, millele järgneb destilleerimine kaltsiumoksiidist, kusjuures võetakse piisavad meetmed, et välistada niiskus reaktsioonist.
K: Kus ma saan osta butürolaktooni / Kas butürolaktooni on ohutu osta?
V: Mul ei ole aimugi, milline on olukord teie riigis. Vastused nendele küsimustele sõltuvad suuresti sellest, kes te olete ja kus te elate. Siiski võite võtta ühendust ükskõik millise GHB-komplekti müüjaga, mida võib leida internetis.
V: Ei, see võib teie tervisele ettearvamatuid tulemusi anda. Riistvarapoodide leelisel ei ole kaugeltki nii rangeid puhtusekriteeriume kui näiteks toiduainetele, ACS-klassile või elektroonikaklassile. Mõned inimesed räägivad edukatest lugudest, kasutades leelist, mis on tõesti võimalik, kuid nagu öeldud, on tulemused ettearvamatud.
K: Mul ei ole klaasnõusid, mida te ütlete, et need on vajalikud, kas ma võin selle asemel lahust keeta potis pliidil?
V: Ei, ei saa. Naatriumhüdroksiid söövitab metalli ja teie tootesse satuvad mitmesugused metalliioonid. Te võite muidugi kasutada lihtsamaid klaasnõusid kui minu soovitustes ja teha vajalikud kohandused menetluses.
K: Ma ei saa Na-GHB-d etanoolist ümberkristalliseerida. See moodustab kleepuva jama.
V: Teie Na-GHB ei ole kuiv või teie etanool ei ole veevaba. Vesi muudab ümberkristalliseerimise peaaegu võimatuks. Asjaolu, et naatrium-GHB on veelduv (hügroskoopiline), ei tee seda paremaks. Enne ümberkristalliseerimise katsetamist või muud improviseeritud alternatiivi tuleb GHB põhjalikult kuivatada, eelistatavalt vaakumeksikaatoris. Etanool, mida te kavatsete kasutada (enamasti tarnitakse puhtusastmega 95%, ülejäänu on vesi), tuleb kuivatada kuivatamise teel veevaba kaltsiumsulfaadi kohal, millele järgneb destilleerimine kaltsiumoksiidist, kusjuures võetakse piisavad meetmed, et välistada niiskus reaktsioonist.
K: Kus ma saan osta butürolaktooni / Kas butürolaktooni on ohutu osta?
V: Mul ei ole aimugi, milline on olukord teie riigis. Vastused nendele küsimustele sõltuvad suuresti sellest, kes te olete ja kus te elate. Siiski võite võtta ühendust ükskõik millise GHB-komplekti müüjaga, mida võib leida internetis.
Prekursorid.
GHB sünteesi ilmne lähteaine on gammabutürolaktoon. Seda saab valmistada sellistest lähteainetest nagu tetrahüdrofuraan (THF) koos oksüdantidega nagu ruteeniumtetroksiid, kaltsiumhüpokloriit ja lämmastikhape. Kasutada võib ka 4-halobutaanhappe derivaate (kloro, bromo, jood). Nagu alljärgnevas sünteesis, saab neid muuta gammabutürolaktooniks destilleerimise teel naatriummetoksiidiga.
gamma-butürolaktoon 4-bromovõihappest.
7,8 g naatriumi lahusele 500 ml absoluutses alkoholis lisati 60,5 g 4-bromovõihapet. Reaktsioonisegu keedeti tagasivoolukondensaatori all umbes viis tundi. Selle aja jooksul eraldus naatriumbromiid. Alkohol destilleeriti auruvannilt ja laktoon eraldati naatriumbromiidist ekstraheerimise teel eetriga. Eeter aurustati ja laktoon destilleeriti tavalise rõhu all. Saagis oli 21,2 grammi (67%) 202-206 °C juures keevat toodet. Alternatiiviks võib olla vabaradikaalne võihappe kloorimine väävelkloriidiga peroksiidide juuresolekul ja isomeeride eraldamine destilleerimise teel, 4-klorovõihappe naatriumsoola valmistamine ja tsükliseerimine laktooniks nagu eespool kirjeldatud 4-bromderivaadi puhul. gamma-butürolaktooni saab valmistada ka 4-metoksvõihappest, 3-fenoksüpropüültsüaniidist, gamma-dietüülaminovõihappest ja beetakloroetüülvinüüleetrist ning paljudest teistest natuke liiga eksootilistest kemikaalidest. Tööstuslikult valmistatakse seda tavaliselt atsetüleeni ja formaldehüüdi reageerimisel kõrge temperatuuri ja rõhu all.
1,4-butandiooli (BDO) dehüdrogeenimine gamma-butürolaktooniks (GBL).
90,1 g (1 mooli) 1,4-butaandiooli, 4 g vaskkromiitkatalüsaatori ja 0,15 g pulbrilise reagendiklassi naatriumhüdroksiidi (või parema KOH) segu segati jõuliselt ja kuumutati tagasilöögi all. Umbes 200 °C juures toimus elav vesiniku areng ja temperatuur langes umbes 10 °C ning dehüdrogeenimine kulges sujuvalt. Gaasi areng (39 l/2 mol 1,4-butandiooli mooli kohta) lakkas umbes 3 tunni pärast. Reaktsioonisegu jahutati toatemperatuurile, filtreeriti katalüsaatorist ja destilleeriti vähendatud rõhu all, et saada gammabutürolaktooni umbes 80% saagisega ja reageerimata 1,4-butandiooli umbes 10% saagisega.
Kõrge aktiivsusega vaskkroomiidi dehüdrogeenimise katalüsaatori valmistamine.
Vask(II)nitraadi trihüdraadi 260 g lahust 900 ml kraanivees temperatuuril 80 °C lisati segades 178 g naatriumdikromaatdihüdraadi ja 225 ml 28% NH4OH lahusele, mis oli 25 °C juures täidetud 900 ml-ni. Sade koguti imufiltreerimise teel ja sumbati kolm korda vees. Vaskammooniumkromaat kuivatati 75-80 °C juures üle öö. See pulbristati ja lisati väikestes kogustes ühe liitri suurusesse 3-kaelasesse kolbi, mis oli varustatud Hershbergi tüüpi roostevabast terasest segistiga, mis kraabiti kolvi põhja lähedale. Kolb uputati osaliselt 350 °C juures olevasse õlivanni (300-320 °C juures võib saada häid tulemusi). Lisamise aeg oli 15 minutit (tekkis palju suitsu) ja segu segati 350 °C juures veel 15 minutit, kui kõik oli lõpetatud. Jahutatud ja must tolmune pulber kasutati nagu on dehüdrogeenimiseks.
Vask(II)nitraadi trihüdraadi 260 g lahust 900 ml kraanivees temperatuuril 80 °C lisati segades 178 g naatriumdikromaatdihüdraadi ja 225 ml 28% NH4OH lahusele, mis oli 25 °C juures täidetud 900 ml-ni. Sade koguti imufiltreerimise teel ja sumbati kolm korda vees. Vaskammooniumkromaat kuivatati 75-80 °C juures üle öö. See pulbristati ja lisati väikestes kogustes ühe liitri suurusesse 3-kaelasesse kolbi, mis oli varustatud Hershbergi tüüpi roostevabast terasest segistiga, mis kraabiti kolvi põhja lähedale. Kolb uputati osaliselt 350 °C juures olevasse õlivanni (300-320 °C juures võib saada häid tulemusi). Lisamise aeg oli 15 minutit (tekkis palju suitsu) ja segu segati 350 °C juures veel 15 minutit, kui kõik oli lõpetatud. Jahutatud ja must tolmune pulber kasutati nagu on dehüdrogeenimiseks.
gamma-butürolaktooni süntees tetrahüdrofuraanist (THF).
7,2 g (0,1 mol) tetrahüdrofuraani 100 ml vees segatud segule lisati 15,1 g naatriumbroraati ja 13,6 g (0,1 mol) kaaliumvesiniksulfaati. Lahuse temperatuuri hoidmiseks vahemikus 25-30 °C oli vajalik väline jahutus. Segamist jätkati 16 tundi toatemperatuuril, mille möödudes oli kogu THF ära kasutatud. Tekkinud ülemäärase broomi kustutamiseks kasutati happelist naatriumsulfitilahust [bisulfit peaks toimima sama hästi]. Seega lisati 140-150 ml 10%-list lahust ja 13,6 g (0,1 mol) kaaliumvesiniksulfaati. Reaktsioon jahutati ja ekstraheeriti 5x30 ml diklorometaaniga. Ühendatud orgaanilised kihid kuivatati MgSO4 kohal ja lahusti eemaldati vaakumis. Jääk destilleeriti ja saadi 73%-lise saagisega gammabutürolaktoon (bp 204-205 °C).
GABA Sandmeyeri reaktsioon GBL/GHB-ks.
See on vinge keemiku jaoks, kes soovib valmistada GHB-d väikestes kogustes ja suure saagisega ning teha seda ilma otseselt reguleeritud kemikaale, nagu gammabutürolaktoon (GBL) või 1,4-butandiool (BDO), saamata. Samuti välditakse sellega tavaliselt madalat saagist, mida võib täheldada tetrahüdrofuraani (THF) oksüdeerimisel. Kasutatakse kergesti saadavat aminohapet, gamma-aminovõihapet (GABA), ja naatriumnitriti (NaNO2). See skaleerub väga kenasti ja töötab ilma suurema vaevata. Ühtegi kahtlast kemikaali ei kasutata.
Sandmeyeri reaktsioonis kasutatakse dilämmastikhapet, et muuta amiinid diasooniumsooladeks. See reaktsioon, nagu seda kohaldatakse GABA muutmisel GHB-ks, on näidatud esimeses reaktsioonis allpool. Alifaatilised diasooniumisoolad hüdrolüüsitakse vee juuresolekul kiiresti, kusjuures eraldub lämmastikgaas ja jääb hüdroksüülrühm. See on näidatud teises etapis. Nende reaktsioonide tulemusel saab GABA-st teha GHB-d ühepotireaktsiooni käigus, mida on lihtne teostada.
Reaktsiooni käivitamine.
Seadke üles 2 L kolb, mis asub jäävees magnetilise segisti peal. Nüüd.
Reaktsiooni käivitamine.
Seadke üles 2 L kolb, mis asub jäävees magnetilise segisti peal. Nüüd.
- Lisage 3mol GABA (309,4 g).
- Lisatakse 3mol NaNO2 (207,0 g).
- Lisatakse 700 ml vett (kogumahuks saab umbes 1100 ml).
- Pange sisse 1" segur ja alustage segamist.
- Täitke 500 ml rõhu tasakaalustatud lisamissahtel 3,3 mol HCl(aq) (385,0 g 31,25%, 334,8 ml 31,25%).
- Paigaldage liitmissahtel gaasi väljalaskeadapter ja ventileerige see väljapoole.
Alustage soolhappe aeglast tilgutamist segusse. Tilgutage seda pidevalt umbes 1 tilk iga 2-5 sekundi järel. Aja möödudes kiirendage seda ja asendage vajaduse korral jääd, kuid ärge laske pruunil mürgise gaasi arenemisel tugevalt areneda. Umbes tund aega pärast viimase tilga lisamist ei ole vaja jääd vahetada. Kui reaktsioon on lõppenud, jätkake ekstraheerimist. (tavaliselt 24-36 tundi hiljem)
Ekstraheerimine.
Selleks on palju võimalusi. See on ikka veel töö, kuid pärast umbes 20 käiku jõudsin seda tööd ära kasutada. Lahustiekstraktsioonide tegemiseks võib kasutada etüülatsetaati (EtOAc), kloroformi või metüleenkloriidi (diklorometaani ehk DCM). Ma olen tavaliselt kasutanud DCM-i, kuna see on tore, kuna orgaaniline kiht langeb eraldussahvri põhja.
1. Seadistus lihtsa destillatsiooni jaoks
Ekstraheerimine.
Selleks on palju võimalusi. See on ikka veel töö, kuid pärast umbes 20 käiku jõudsin seda tööd ära kasutada. Lahustiekstraktsioonide tegemiseks võib kasutada etüülatsetaati (EtOAc), kloroformi või metüleenkloriidi (diklorometaani ehk DCM). Ma olen tavaliselt kasutanud DCM-i, kuna see on tore, kuna orgaaniline kiht langeb eraldussahvri põhja.
1. Seadistus lihtsa destillatsiooni jaoks
a) Destilleerige, visates välja esimesed 5-10 ml destillaati, kuna see sisaldab üsna palju lämmastikoksiide. Destilleerige võimalikult palju vett maha, põhimõtteliselt seni, kuni naatriumkloriid hakkab veekihti küllastama ja sadestuma.
b) Ülejäänud destillaat (umbes 700 ml) sisaldab umbes 1 g GBL/10 ml.
c) Ülejäänud destillaat töödeldakse NaHCO3-ga 30 minuti jooksul tagasivoolu juures.
d) Keedetakse umbes 5 % mahu aktiivsöega (st .35 ml aktiivsütt) (võrreldes lahuse mahuga) 5-10 minutit.
e) Laske jahtuda ja filtreerige, peske aktiivsütt destilleeritud veega. Säilitage NaGHB.
2. Ülejäänud veega ekstraheerige 5 korda 625 ml DCM-i portsjonitega.
3. Destilleerige DCM maha (DCM uuesti kasutada!).
4 . Destilleerige GBL (vaakumis, kui see on olemas).
5 . Reageeritakse NaHCO3 ja destilleeritud veega ning töödeldakse aktiivsöega nagu eelnevalt.
Tavaliselt valmistatakse lahustiga ekstraheeritud GBList 375 g NaGHB-d, millest 100 g NaGHB-destillaadist. Kuigi konversioon on peaaegu kvantitatiivne (mõõdetuna GC/MS-ga), on üldine saagis tavaliselt umbes 70 %.
3. Destilleerige DCM maha (DCM uuesti kasutada!).
4 . Destilleerige GBL (vaakumis, kui see on olemas).
5 . Reageeritakse NaHCO3 ja destilleeritud veega ning töödeldakse aktiivsöega nagu eelnevalt.
Tavaliselt valmistatakse lahustiga ekstraheeritud GBList 375 g NaGHB-d, millest 100 g NaGHB-destillaadist. Kuigi konversioon on peaaegu kvantitatiivne (mõõdetuna GC/MS-ga), on üldine saagis tavaliselt umbes 70 %.
Last edited:
